
科目: 来源: 题型:
【题目】某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.下列说法正确的是( ) 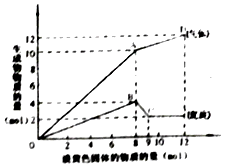
A.溶液中一定含有Mg2+、NH4+、Al3+ , 可能含有Fe2+
B.图中A点产生的气体总质量为230克
C.图中A到D之间会产生有刺激性气味的气体
D.图中B到C之间发生的化学反应一定是氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置(电极均为惰性电极)可吸收SO2 , 并用阴极排出的溶液吸收NO2 . 下列说法正确的是( ) 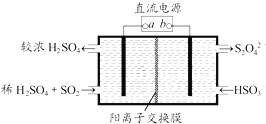
A.a为直流电源的负极
B.阴极的电极反应式为:2HSO3﹣+2H++e﹣═S2O42﹣+2H2O
C.阳极的电极反应式为:SO2+2H2O﹣2e﹣═SO42﹣+4H+
D.电解时,H+由阴极室通过阳离子交换膜到阳极室
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A有如图所示的转化关系 
已知①有机物B是芳香烃的含氧衍生物,其相对分子质量为108,B中氧的质量分数为14.8%
②CH3CH2COOH+Cl2 ![]()
![]() +HCl
+HCl
③G分子结构中含有3个六元环
根据以上信息,回答下列问题:
(1)有机物F中官能团的名称是 .
(2)A的名称是 .
(3)条件Ⅲ 为 , F→G的反应类型为 , G的结构简式为 .
(4)写出一种检验M中官能团的化学方程式
(5)R是N的同系物,相对分子质量比N大14,R有多种同分异构体,则同时符合下列条件的同分异构体有种,其中核磁共振氢谱为4组峰,且峰面积之比为3:2:2:1的有机物结构简式为 . a.含有笨环 b.能发生银镜反应 c.遇FeCl3溶液不显紫色 d.不含醚键
(6)写出下列转化的化学方程式:F→E .
查看答案和解析>>
科目: 来源: 题型:
【题目】海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl﹣、SO42﹣、Br﹣、CO32﹣HCO3﹣等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.
(1)火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示: 
(i)天然海水的pH≈8,呈弱碱性.用离子方程式解释主要原因 .
(ii)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是;氧化后的“海水”需要用大量的天然海水与之混后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
(iii)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=(用含硫微粒浓度的代数式表示).
(iv)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为 , 所得溶液中c(H+)﹣c(OH﹣)=(填字母编号).
A.c(SO32﹣)﹣c(H2SO3) B.c(SO32﹣)+c(NH3 . H2O)﹣c(H2SO3)
C.c(HSO3﹣)+c(SO32﹣)﹣c(NH4+) D.c(HSO3﹣)+2c(SO32﹣)﹣c(NH4+)
(2)重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g/mL)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
难溶 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10﹣17 | 5.6×10﹣8 | 6.3×10﹣50 | 7.1×10﹣9 | 1.2×10﹣15 | 3.4×10﹣28 |
(i)你认为往废水中投入(填字母序号),沉淀效果最好.
A.NaOH B.Na2S C.KI D.Ca(OH)2
(ii)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= .
(iii)如果用食盐处理只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(ρ≈1gmL﹣1).若环境要求排放标准为c(Ag+)低于1.0×10﹣8mol/L,问该工厂处理后的废水中c(Ag+)= . (已知KSP(AgCl)=1.8×10﹣10)
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气污染是造成雾霾天气的重要原因之一,解决这个问题除了限制汽车出行外,更重要的是研发催化汽车尾气的转化技术,该技术中催化剂及载体的选择和改良是关键,某稀土催化剂催化转化汽车尾气示意图如图甲 
(1)下列有关说法正确的是 . a.C3H8与CH3CH=CH3一样,分子中碳原子都采用的是SP3杂化
b.N2、CO2、H2O都是非极性分子
c.每个CO2分子中,含有2个π键和2个σ键+
d.CO的一种等电子体为NO+ , 它的电子式为 ![]()
(2)CO与Fe可生成羰基铁[Fe(CO)5],已知其中铁为0价,铁原子的基态核外电子排布式为 , [Fe(CO)5],中配位原子是 , 理由是 .
(3)C、N、O三种元素的第一电离能由大到小的顺序是 , Al2O3晶体熔点高是耐火材料,AlCl3晶体易升华,熔点低,工业上电冶制取铝用前者而不用后者的原因是 .
(4)钙钛矿型符合氧化物也可作为汽车尾气转化的催化剂,一种复合氧化物晶胞结构如图乙所示,则与每个Sr2+与个O2﹣紧邻,若Sr2+与紧邻O2﹣的核间距为apm,阿伏加德罗常数为NA , 则该氧化物晶体密度的计算表达式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作正确的是( )
A.用量筒量取 5mL 蒸馏水
B.用分液漏斗分离乙醇和水
C.用托盘天平称量 NaCl 固体 5.8g
D.用 pH 试纸测氯水的 pH
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.Na2O2吸收 CO2 产生 O2,可用作呼吸面具供氧剂
B.ClO2 具有还原性,可用于自来水的杀菌消毒
C.碘化钾可用作加碘食盐的添加剂
D.镁是优质的耐高温材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com