
科目: 来源: 题型:
【题目】氮元素的化合物种类繁多,性质也各不相同.
(1)图1为一定温度下1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图.已知E1=147.5kJmol﹣1 , E2=376.2kJmol﹣1(E1、E2为反应的活化能).若在反应体系中加入催化剂,反应速率增大,则E1(填“增大”、“减小”或“不变”).该反应的热化学方程式为 . 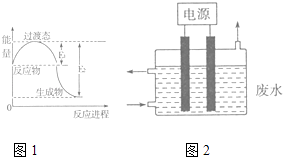
(2)硝基苯甲酸乙酯在OH﹣存在的条件下发生水解反应:
O2NC6H4COOC2H5+OH﹣O2NC6H4COOO﹣+C2H5OH
两种反应物的初始浓度均为0.050molL﹣1 , 某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如下表所示:
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
α/% | 0 | 33 | 42 | 49 | 59 | 73 | 74 | 75 | 75 |
回答下列问题:①该反应在330s~530s的平均反应速率为(只列算式,不做运算)
②为提高O2NC6H4COOC2H5的转化率,可以采取的措施有 . (写1条即可)
(3)2015年8月12日天津港爆炸中有一定量的氰化物泄露,可用如图2所示装置除去含CN﹣、Cl﹣废水中的CN﹣ , 控制溶液pH为9~10,阳极产生的ClO﹣将CN﹣氧化为两种无污染的气体,该反应的离子方程式为 , 其中两个电极的材料分别为石墨和铁,则石墨作极,其电极反应式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】氯碱工业中电解饱和食盐水的原理示意图如图所示: 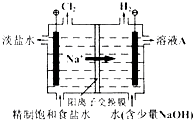
(1)溶液A的溶质是;
(2)电解饱和食盐水的离子方程式是;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用平衡移动移动原理解释盐酸的作用:
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组欲对含少量硫酸亚铁和硫酸铁的硫酸铜溶液进行综合实验:
(1)除去Fe2+和Fe3+并制备CuSO45H2O,请根据以下流程回答问题:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 1.9 | 6.5 | 4.7 |
沉淀完全的pH | 3.7 | 9.7 | 6.7 |
①试剂X的化学式为 , 加入试剂Y调节溶液pH的范围是;
②操作a用到的玻璃仪器为烧杯,玻璃棒和;操作b的名称为;
(2)已知:5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O,欲测定混合溶液中的Fe2+的浓度,取待测液20.00mL,用浓度为0.01molL﹣1的酸性KMnO4溶液滴定,下列滴定方式中,最合理的是(填字母序号,夹持部分已略去)
达到终点时用去酸性KMnO4溶液12.00mL,请计算c(Fe2+)= .
查看答案和解析>>
科目: 来源: 题型:
【题目】丙酮(C3H6O)通常是无色液体,易溶于水,密度小于1 g·mL-1,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,下列最为合理的是( )
A. 蒸馏 B. 分液 C. 过滤 D. 蒸发
查看答案和解析>>
科目: 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. 
根据判断出的元素回答问题:
(1)y在元素周期表中的位置是 . z、d、e、f四种元素的简单离子中,半径最大的是(填离子符号)
(2)e的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程 式
(3)z的氢化物和h的氢化物反应形成化合物A,A中含有的化学键类型为;
(4)含f的某化合物可用作净水剂的原理是(用离子方程式表示)
(5)25℃,f的最高价氧化物的水化物的Ksp=1.0×10﹣34 , 使含0.1molL﹣1 f离子的溶液开始产生沉淀的pH为 .
(6)元素e和g组成的化合物B的水溶液中离子浓度由大到小的顺序为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】我国已发射“嫦娥I号”卫星,卫星运载火箭的动力由高氯酸铵(NH4ClO4)分解提供。高氯酸铵分解有可能排入大气的物质是 ( )
A.H2OB.SO2C.CO2D.CO
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是( )
A. NaCl的摩尔质量是58.5g/mol B. 1mol NaOH的质量是40g
C. 1mol氮的质量是14g D. 摩尔不是物理量
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:CH3CH2CH2CH3(g)+6.5O2(g)![]() 4CO2(g)+5H2O(l) ΔH=-2878kJ·mol-1 (CH3)2CHCH3(g)+6.5O2(g)→ 4CO2(g)+5H2O(l) ΔH=-2869kJ·mol-1
4CO2(g)+5H2O(l) ΔH=-2878kJ·mol-1 (CH3)2CHCH3(g)+6.5O2(g)→ 4CO2(g)+5H2O(l) ΔH=-2869kJ·mol-1
下列说法正确的是( )
A.正丁烷分子储存的能量大于异丁烷分子
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨工业的核心反应:N2(g)+3H2(g)![]() 2NH3(g)的反应过程中能量变化如图所示,回答下列问题:
2NH3(g)的反应过程中能量变化如图所示,回答下列问题:
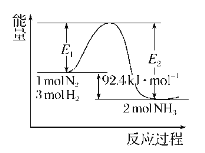
(1)ΔH=______;在反应体系中加入催化剂,反应速率增大,E2的变化是______(填“增大”“减小”或“不变”);△H (填“增大”“减小”或“不变”)。
(2)在500℃、2×107 Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_______(填“<”“>”或“=”)46.2 kJ,理由__________________________________。
(3)已知在25℃、101 kPa时,14克CO气体完全燃烧放出热量为Q kJ。
请写出CO燃烧热的热化学方程式:______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述一定正确的是( ) 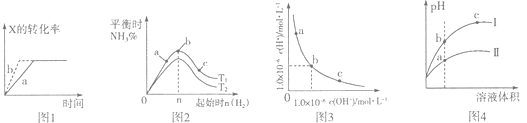
A.图l所示,反应:X(g)+2Y(g)═3Z(g),b的压强一定比a大
B.图2表示合成氨反应,温度T1和T2对应的平衡常数为K1、K2 , 则:T1<T2 , K1>K2
C.图3表明,该温度下,加入FeCl3不可能引起由b向a的变化
D.图4所示,用水稀释pH相同的盐酸和醋酸,I表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com