
科目: 来源: 题型:
【题目】下列有关0.1mol/LNa2S溶液的叙述正确的是( )
A.该溶液中存在两个平衡、七种粒子
B.该溶液中K+、NH ![]() 、NO
、NO ![]() 、Al3+可以大量共存
、Al3+可以大量共存
C.滴加少量稀硫酸,充分振荡无现象
D.通入足量SO2气体,发生反应的离子方程式:2S2﹣+SO2+2H2O═3S↓+4OH﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将0.1molL﹣1氢氧化钠溶液与0.06molL﹣1硫酸溶液等体积混合,该混合溶液的pH等于( )lg2=0.3.
A.1.7
B.2.0
C.12.0
D.11.7
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1molNa与O2完全反应生成Na2O和Na2O2的混合物,转移电子NA , 生成物中离子总数为2NA
B.1LpH=2的NaHSO3溶液中,由水电离的H+数目为0.01 NA 个
C.1.5gCH3+里含有的电子数目为NA
D.62g白磷中含有P_P键的数目为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g)2XY(g)△H<0达到甲平衡,仅改变某一条件后,达到乙平衡.对此过程的分析正确的是( ) 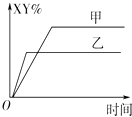
A.可能是减小了反应物的浓度,反应物X2转化率一定减小
B.可能是加入了催化剂,反应物X2百分含量(X2%)将增大
C.可能是缩小了容器的体积,但该反应的平衡常数保持不变
D.可能是升高了温度,该反应的平衡常数一定减小
查看答案和解析>>
科目: 来源: 题型:
【题目】今有铁和铜的混合物17.5g,其中铁的质量分数为32%,与足量盐酸反应。
(1)参加反应的铁的物质的量是多少;__________
(2)生成标准状况下的氢气的体积__________
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量的K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于指定容器中,加入足量的水,搅拌、静置、过滤.取滤液,用铂电极电解一段时间.则两极区析出的氧化产物与还原产物的质量比约为( )
A.35.5:108
B.108:35.5
C.8:1
D.1:2
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚砜(SOCl2)为无色或浅黄色发烟液体,易挥发,遇水反应,其制取过程的相关反应如下:S(s)+Cl2(g) ![]() SCl2(l) (Ⅰ)
SCl2(l) (Ⅰ)
SCl2(l)+SO3(l)═SOCl2(l)+SO2(g)(Ⅱ)
已知二氯化硫(SCl2)熔点﹣78°C,沸点59°C,如图是实验室由氯气与硫合成二氯化硫的装置.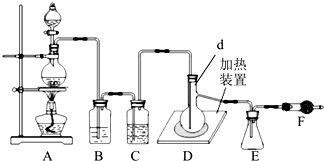
(1)仪器组装完成后,检查装置气密性的操作是;反应前要先排尽系统中空气,此做法目的是 .
(2)装置D中玻璃仪器d的名称是 , 向其中放入一定量的硫粉,加热使之融化,轻轻摇动使硫附着在容器的内壁,形成一薄层膜,这样做的优点是 .
(3)实验时,为防止E中液体挥发,可采取的措施是 . 装置F(盛放碱石灰)的作用是 , .
(4)工业上以硫黄、液氯和液体三氧化硫为原料,能生产高纯度(99%以上)氯化亚砜,为使原子的利用率达到100%,三者的物质的量比为;已知:SOCl2+4NaOH═Na2SO3+2NaCl+2H2O.
供选择的试剂:稀盐酸、稀硝酸、氯化钡溶液、硝酸银溶液、品红溶液请设计简单的实验来验证氯化亚砜与水完全反应的产物,简要说明实验操作、现象和结论 .
查看答案和解析>>
科目: 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.
(1)已知:CO(g)+H2O(g)H2(g)+CO2(g)△H=﹣41kJmol﹣1C(s)+2H2(g)CH4(g)△H=﹣73kJmol﹣1
2CO(g)C(s)+CO2(g)△H=﹣171kJmol﹣1
工业上可用煤制天然气,生产过程中有多种途径生成CH4 . 写出CO与H2反应生成CH4和H2O的热化学方程式 .
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 .
(3)用天然气制取H2的原理为:CO2(g)+CH4(g)2CO(g)+2H2(g).在密闭容器中通入物质的量浓度均为0.1molL﹣1的CH4与CO2 , 在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)v(逆)(填“大于”、“小于”或“等于”).求Y点对应温度下的该反应的平衡常数K= . (计算结果保留两位有效数字)
(4)以二氧化钛表面覆盖CuAl2O4 为催化剂,可以将CH4和CO2直接转化成乙酸.①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是 .
②为了提高该反应中CH4的转化率,可以采取的措施是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA代表阿伏加德罗常数,下列说法中正确的是( )
A. 1 mol水含有的氢原子数目为NAB. 1 mol氩气分子所含的原子数目为2NA
C. 0.5 mol碳酸钠中含有的钠离子为0.5NAD. 0.5 mol硝酸中含有的氧原子为1.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com