
科目: 来源: 题型:
【题目】硫及其化合物在工业上有着广泛的应用.
完成下列填空:
(1)写出工业上以硫磺为原料生产硫酸的第一步反应方程式 .
(2)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,主要反应如下:
Mn2++S2O82﹣+H2O→ MnO4﹣+SO42﹣+H+
配平该反应方程式,氧化产物是 .
(3)用电解硫酸氢钾的方法制取过硫酸钾:HSO4﹣在(填:“阳极”或“阴极”)反应生成S2O82﹣ , 另一极生成氢气,生成0.1mol的S2O82﹣同时可收集到 g氢气.
(4)已知硫酸的第二级电离并不完全:HSO4﹣![]() H++SO42﹣(Ki=1.2×10﹣2);
H++SO42﹣(Ki=1.2×10﹣2);
在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是 , 第4位的离子是 . 往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中 ![]() (填:“增大”、“减小”或“不变”)
(填:“增大”、“减小”或“不变”)
(5)已知:HSO3﹣H++SO32﹣,K=1.02×10﹣7
NH4++H2ONH3H2O+H+ , K=5.65×10﹣10
往亚硫酸氢铵中加入一定量的氢氧化钡溶液,可能发生的反应离子方程式是(选填编号).
a.HSO3﹣+Ba2++OH﹣→BaSO3↓+H2O
b.NH4++2HSO3﹣+2Ba2++3OH﹣→2BaSO3↓+2H2O+NH3H2O
c.NH4++HSO3﹣+Ba2++2OH﹣→BaSO3↓+H2O+NH3H2O
d.2NH4++4HSO3﹣+3Ba2++6OH﹣→3BaSO3↓+4H2O+2NH3H2O+SO32﹣ .
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在1400~1450℃的氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g)高 ![]() Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡. 完成下列填空:
Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡. 完成下列填空:
(1)上述反应所涉及的元素,原子半径由大到小的顺序是 . 其中一种元素的原子核外s电子数与p电子数相等,写出它的最外层电子排布的轨道表示式 .
比较碳、硅两种元素的非金属性强弱,可以通过比较(填:化合物性质的差异)来判断.
(2)上述反应混合物中的极性分子是 , 写出非极性分子的电子式 . 从晶体类型的角度分析用氮化硅制造发动机中耐热部件的原因是
(3)下列措施可以提高二氧化硅转化率的是(选填编号).a.增加二氧化硅用量b.升高反应温度
c.增大气体压强 d.向反应容器中多充入氮气
(4)下列描述中能说明反应已达平衡的是(选填编号).a.c(CO)=3c(N2) b.v (CO)=3v(N2)
c. ![]() 保持不变d.气体的压强保持不变
保持不变d.气体的压强保持不变
(5)测得平衡时固体质量减少了11.2g,则用氮气表示的平均反应速率为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、Q、W、R六种短周期元素原子序数依次增大。化合物甲俗称苛性钠,由X、Z、Q三种元素组成。医学中常用QR溶液配制生理盐水。化合物乙由X、R两种元素组成。请回答下列问题:

(1)Q的离子结构示意图为_________。
(2)Y元素的单质及其化合物能发生如上图所示的转化,则Y元素在元素周期表中的位置__________,在甲溶液中通入少量YZ2气体,写出该反应的离子方程式:_______________。
(3)W的单质既能与甲溶液反应,又能与乙溶液反应。
①常温下,将W的单质和甲溶液混合,发生反应的离子方程式为_________________________。
②下列表述中能证明Q的金属性强于W的是______(填序号)。
a.Q单质的熔点比W单质的低
b.W的原子序数大
c.Q的最高价氧化物的水化物的碱性比W的最高价氧化物的水化物的碱性强
d.将Q、W的单质置于水中,Q单质与水剧烈反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法中正确的是
A.NH3与HCl气体或CO2气体均不能共存
B.铵盐溶液与NaOH溶液混合后会有NH3逸出
C.硅、二氧化硅、硅酸、铵盐受热均很稳定
D.SiO2能溶解在NaOH溶液但不能溶解在氨水中
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列转化关系(反应条件略去),A、B、C、D中均含有同一种元素,回答下头问题:
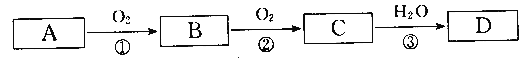
(1)若A为Na,写出反应③的化学方程式___________________________
(2)若A为N2,写出反应③的离子方程式___________________________
(3)若A为S,写出D的浓溶液与Cu在加热情况下反应的化学方程式_________________
(4)若A为NH3,写出过量Fe与D的稀溶液反应(还原产物只有B)的离子方程式_____________________________,将14 g铜、银合金与一定量某浓度的D溶液完全反应,将放出的气体与1.12 L(标准状况)氧气混合通入水中,恰好全部被水吸收,则合金中铜的质量是________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实能用同一原理解释的是
A.Cl2与Fe、Cu反应均生成高价氯化物 B.NH4HCO3晶体、固体I2受热均能变成气体
C.SO2、Cl2均能使品红溶液褪色 D.ClO与 Fe2+、H+均不能大量共存
查看答案和解析>>
科目: 来源: 题型:
【题目】溶液、胶体和浊液这三种分散系的根本区别是( )
A. 分散质粒子直径的大小B. 光束穿过胶体时形成一条光亮的通路
C. 能否透过滤纸或半透膜D. 是否均一、透明、稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】现有氢气与氯气的混合气体0.1mol,经充分反应后,通入60mL 2mol/L的NaOH溶液中,所得溶液中只含有2种溶质,其中NaCl为0.1mol.则原混合气体中氢气的物质的量可能是( )
A.0.03mol
B.0.04mol
C.0.05mol
D.0.06mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ||||||||
2 | B | C | D | E | ||||
3 | A | F | J | G | I |
(1)表中元素,化学性质最不活泼的是_______,最高价氧化物的水化物酸性最强的是__________
(2)B、C、D、E、G形成的气态氢化物中,最稳定的是________________
(3)A元素的最高价氧化物的水化物中所含化学键类型_________________,D元素的简单气态氢化物的电子式为_________,J的某原子中含有15个中子,试用恰当符号表示出该原子________
(4)E、F、G形成的简单离子半径由大到小的顺序________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com