
科目: 来源: 题型:
【题目】硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
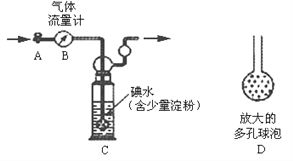
(1)洗气瓶C中发生反应的化学方程式为:_______________;
(2)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:___________________;
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量将_________(填“偏高”、“偏低”或“无影响”);
(4)下列试剂中,可以用来替代洗气瓶C中溶液的是_________。(选填字母编号)
a.NaOH溶液 b.品红溶液
c.酸性高锰酸钾溶液 d.Na2CO3溶液
乙方案:实验步骤如以下流程图所示:
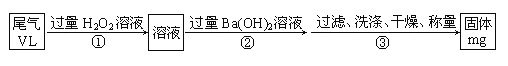
(5)写出步骤②中反应的离子方程式;_________________________
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为________________(用含V、m的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】固定容积为2L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图I表示t℃时容器中各物质的量随时间的变化关系,图II表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
zC(g),图I表示t℃时容器中各物质的量随时间的变化关系,图II表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
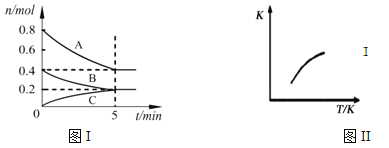
A. 该反应可表示为:2A(g)+B(g)![]() C(g)ΔH﹤0
C(g)ΔH﹤0
B. t℃时该反应的平衡常数K=6.25
C. 当容器中气体密度不再变化时,该反应达到平衡状态
D. t℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用NaHCO3和KHCO3组成的混合物进实验,测得的实验数据如下表所示(盐酸的物质的量浓度相同):(计算结果保留3位有效数字)
实验编号 | ① | ② | ③ |
盐酸体积(mL) | 50 | 50 | 50 |
混合物的质量(g) | 9.2 | 15.7 | 27.6 |
标准状况下CO2的体积(L) | 2.24 | 3.36 | 3.36 |
回答下列问题:
(1)由实验______________(填实验编号)可判断盐酸完全反应,理由是_____________。
(2)盐酸的物质的量浓度为__________________。
(3)产生标准状况下3.36LCO2所需固体的质量为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究钠及其化合物有重要意义。
(1)实验室配制0.1molL-1的碳酸钠溶液480mL,根据配制溶液的过程,回答问题:
①实验中除需要托盘天平(带砝码)、药匙、烧杯和玻璃棒外,还需要的其他玻璃仪器是_________。
②实验中需用托盘天平(带砝码)称量碳酸钠固体_______________g。
③某同学配制 Na2CO3溶液的过程如图所示。你认为该同学的错误有___________。

A.①⑥ B.②④⑦ C.①⑤⑥ D.⑤⑥⑦
④下列实验操作会使配得的溶液浓度偏小的是___________。
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.容量瓶使用前没有经过干燥,瓶中有少量的水
C.在容量瓶中定容时俯视刻度线
D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度
(2)过氧化钠保存不当容易变质生成Na2CO3。某过氧化钠样品已经部分变质,请你设计实验,限用一种溶液和水,证明过氧化钠已经部分变质:_________________(说明操作、现象和结论)。
查看答案和解析>>
科目: 来源: 题型:
【题目】通常检测SO2含量是否达到排放标准的反应原理是SO2 +H2O2 + BaCl2 ===BaSO4↓+ 2HCl。NA表示阿伏伽德罗常数,下列说法正确的是( )
A. 0.1 mol BaCl2晶体中所含微粒总数为0.1NA
B. 25 ℃时,pH =1的HCl溶液中含有H+的数目为0.1NA
C. 17 g H2O2中含有非极性键数目为0.5NA
D. 生成2.33 g BaSO4沉淀时,转移电子数目为0.01NA
查看答案和解析>>
科目: 来源: 题型:
【题目】氮是生命物质的重要组成元素之一,以氮气为原料的合成氨工业可以实现大规模固氮,氨可用于生成氯化铵、硫酸铵等化学肥料。
(1)科学家已成功合成少量N4分子,N4和N2互为_____,NH3分子的空间构型为型______。
(2)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32L(标况下)氮气,至少需要叠氮酸钠_____g,转移电子____个。
(3)检验铵态氮肥中铵根离子的实验方案是(补充写出步骤,现象):取样,溶于水_________________________________________________。
(4)等物质的量浓度的两溶液,pH大小为:氯化铵__________硫酸铵(选填>、=或< ,下同);铵根离子浓度相同的两溶液,两者的浓度大小关系为:氯化铵_____硫酸铵;
最新“人工固氮”的研究报道:常温常压、催化剂条件下, N2在催化剂表面与水发生反应:与水发生反应: 2N2(g)+6H2O(g)![]() 4NH3(g)+3O2(g)-Q,(Q>0)
4NH3(g)+3O2(g)-Q,(Q>0)
(5)如果反应的平衡常数K值变小,该反应正反应速率_______ (选填增大、减小或不变,下同),逆反应速率_______.
(6)若反应在恒容条件下进行,请用上述反应中的有关物理量来说明该反应已达到平衡状态_______.
(7)下列能够提高氮气转化率的措施是:_____
A.适当升高温度 b.增加水的用量
C.使用高效催化剂 d.扩大容器体积
查看答案和解析>>
科目: 来源: 题型:
【题目】自然界的矿物,岩石的成因和变化收到许多条件的影响。地壳内每增加1km,压强增大约25000-30000kPa。在地壳内SiO2和HF存在一下平衡:SiO2(s) +4HF(g) ![]() SiF4(g)+ 2H2O(g) +148.9kJ。
SiF4(g)+ 2H2O(g) +148.9kJ。
(1)写出H2O的电子式:___________,SiF4的结构式:____________
(2)在地壳深处容易有___________气体逸出,在地壳浅处容易有___________沉积。该反应的平衡常数表达式为:K=_______________。如果上述反应的平衡常数K值变大,该反应_______(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,______(选填编号)。
a.2v正(HF)=v逆(H2O) b.v正(H2O)=2v逆(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)钠元素的金属性比铝的________(填“强”或“弱”)。
(2)将一小块金属钠投入水中,发生反应的离子方程式为______________________;可观察到的实验现象是________(填序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)呼吸面具的原理:________________,_______________________。
(4)填写a、b、c化学式并书写①、②的离子方程式(a、b、c均为含Al化合物);
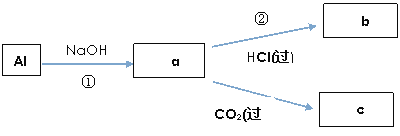
a:____________,b:_____________,c:____________;
①____________________________________________;
②____________________________________________;
(5)Fe跟Cl2在一定条件下反应,所得产物的化学式是________。将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成________色。
b.向另一支试管中滴加NaOH溶液,现象为___________________________,反应的离子方程式是________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列判断中一定正确的是( )
A. NaCl及Na2O2固体中阴、阳离子数之比均为1:1
B. 等质量的O2与O3中,氧原子的个数比为3:2
C. 分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1:2
D. 10 mL 0.3 mol·L-1 NaCl溶液与30 mL 0.1 mol·L-1 AlCl3溶液中Cl -物质的量浓度比为1:3
查看答案和解析>>
科目: 来源: 题型:
【题目】2017年我国首艘使用了钛合金材料的国产航母下水。钛(Ti)常温下与酸、碱均不反应,但高温下能被空气氧化。由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如图,下列说法错误的是
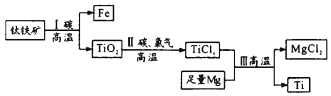
A. 步骤I中碳作还原剂
B. 步骤II中未发生氧化还原反应
C. 步骤III需在氩气环境中进行,防止金属被空气氧化
D. 可用稀硫酸除去金属钛中的少量镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com