
科目: 来源: 题型:
【题目】A、B、C、D、E、F 是原子序数依次增大的短周期主族元素。E 是同周期金属性最强的元素。甲、乙、丙、丁、戊是由上述部分元素中的两种或几种组成的化合物,它们之间的转化关系如图所示。其中甲是生活中的调味品,丁是淡黄色固体。下列说法不正确的是

A. 元素B的氢化物可能具有正四面体结构
B. 元素上的氧化物对应水物化的酸性一定比硫酸的酸性强
C. 原子半径:r(E)>r(F)>r(C)>r(D)
D. 化合物A4BC2D既可能是共价化合物,也可是离子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列烷烃的沸点是甲烷:-164℃,乙烷-89℃,丙烷:-42℃,戊烷:36℃。由此,推断丁烷的沸点可能:
A.低于-170℃B.约为-1℃C.高于36℃D.-100℃
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050 mol SO2和0.030 mol O2放入容积为1 L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。
①从平衡角度分析采用过量O2的目的是________________________;
②计算该条件下反应的平衡常数K=________________________。
③已知:K(300℃)>K(350℃),该反应是________热反应。若反应温度升高,SO2的转化率________ (填“增大”、“减小”或“不变”)。
(2)某温度下,SO2的平衡转化率(![]() )与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”,下同)。
)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”,下同)。
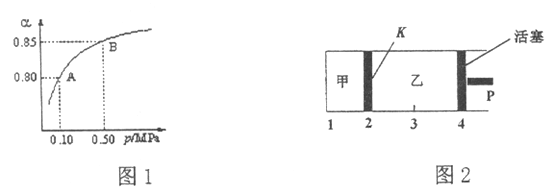
(3)如图2所示,保持温度不变,将2 mol SO2和1 mol O2加入甲容器中,将4 mol SO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲______乙。
②若保持乙中压强不变,向甲、乙容器中通入等质量的氦气,达到新平衡时,SO3的体积分数甲_______乙。
查看答案和解析>>
科目: 来源: 题型:
【题目】摩拜单车利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,电池反应原理为LiCoO2 +6C![]() li1-xCoO2 +lixC6,结构如图所示。下列说法正确的是
li1-xCoO2 +lixC6,结构如图所示。下列说法正确的是
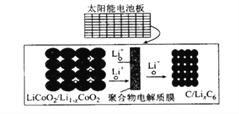
A. 放电时,正极质量增加
B. 充电时,锂离子由右向左移动
C. 该钾离了电池工作时,涉及到的能量形式有3 种
D. 充电时、阳极的电极反应式为Li1-xCoO2+xLi++xe-= LiCoO2
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,关于下列两个反应:
a、0.1 mol/L 醋酸溶液:CH3COOH![]() CH3COO-+H+
CH3COO-+H+
b、0.1 mol/L 醋酸钠溶液:CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
(1)两式到达平衡后,加入一定量的水后,平衡向右移动的是________,溶液的pH增大的是________________。
(2)向b反应中加入少量的醋酸钠固体,溶液的pH将________,若加入同浓度的醋酸钠溶液,溶液的pH将________(填“增大”、“减小”、“不变”)。
(3)若向a反应中加入少量的醋酸钠固体,溶液的pH将________,电离程度将________,溶液的导电性将________(填“增大”、“减小”、“不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学查阅教材得知,普通锌锰电池筒内无机物的主要成分为MnO2、NH4C1、ZnCl2等。他在探究废干电池内的黑色固体回收利用时,进行如图所示实验。下列有关实验的叙述不正确的是
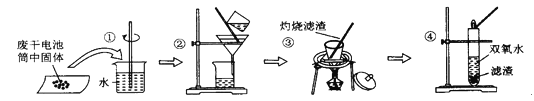
A. 操作①中玻璃棒能加快固体溶解
B. 操作②为过滤,得到的滤液显酸性
C. 操作③盛放药品的仪器是坩埚
D. 操作④的目的是除去滤渣中的杂质
查看答案和解析>>
科目: 来源: 题型:
【题目】在2HI(g)![]() H2(g)+I2(g)中,三种分子化学键断裂时能量变化如图1所示。其他条件相同,1 mol HI在不同温度分解达平衡时,测得体系中I2物质的量随温度变化的曲线如图2所示。
H2(g)+I2(g)中,三种分子化学键断裂时能量变化如图1所示。其他条件相同,1 mol HI在不同温度分解达平衡时,测得体系中I2物质的量随温度变化的曲线如图2所示。
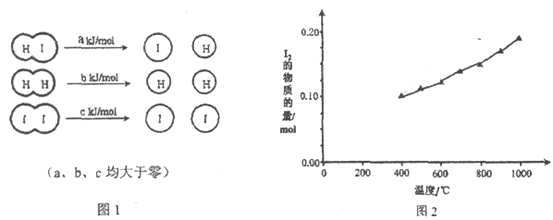
(1)比较2a________b+c(填“<”、“>”或“=”),理由是________________。
(2)某温度下该反应平衡常数为1/64,达平衡时,1 mol HI分解的转化率为________________。
(3)若利用此反应制备I2,则提高HI转化率的措施是________(填字母序号)。
a. 移走I2 b. 加压 c. 升温 d. 增大HI浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】50ml浓H2SO4溶液(足量)中加入3.2gCu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是_____________生成SO2的体积为(标准状况下)____________mL.
(2)若题干中浓硫酸的物质的量浓度为amol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)____0.025amol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,则原浓硫酸的物质的量浓度为_____________.
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,ksp(CaC2O4)=2.4×10-9,下列有关0.10mol/L草酸钠(Na2C2O4)溶液的说法,正确的是
A. 溶液中各离子浓度大小关系c(Na+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+)
B. 若向溶液中不断加水稀释,溶液中各离子浓度均减小
C. 若用pH计测得此溶液的pH=a,则H2C2O4的第二级电离平衡常数约为Ka2=1013-2a
D. 若向该溶液中加入等体积CaCl2溶液后能够产生沉淀,则CaCl2溶液的最小浓度应该大于2.4×10-8mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com