
科目: 来源: 题型:
【题目】设 NA为阿伏加德罗常数的数值.下列说法正确的是
A. 标准状况下, 78g 苯中含有碳碳双键的数目是 3 NA
B. 18g D2O 含有 10NA个质子
C. 28 g 聚乙烯中含有的原子数目为 6NA
D. 56g 铁片投入足量浓 H2SO4中生成 NA个 SO2分子
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酰氯(SO2Cl2) 和亚硫酰氯(SOCl2) 均是重要的化工试剂,遇水发生剧烈反应,常用作脱水剂。
已知:①SO2Cl2 (g)![]() SO2(g)+Cl2(g) △H= +471.7kJ/mol; 平衡常数K1
SO2(g)+Cl2(g) △H= +471.7kJ/mol; 平衡常数K1
②SO2(g) +Cl2(g) +SCl2(g)![]() 2SOCl2(g) △H=-477.3kJ/mol; 平衡常数 K2
2SOCl2(g) △H=-477.3kJ/mol; 平衡常数 K2
(1)反应2SOCl2(g)![]() SO2Cl2(g)+SCl2(g)的平衡常数K=_____(用K1、K2表示) 该反应△H=_____kJ/mol。
SO2Cl2(g)+SCl2(g)的平衡常数K=_____(用K1、K2表示) 该反应△H=_____kJ/mol。
(2)若在绝热、恒容的密闭容器中,投入一定量的SO2Cl2(g)和SCl2(g),发生反应SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是____(填序号)。
2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是____(填序号)。

(3)为研究不同条件对反应①的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molSO2Cl2,10min后反应①达到平衡。测得10min内v(SO2)= 8.0×10-3mo1·L-1·min-1,则平衡时SO2Cl2的转化率α1=_______。若其它条件保持不变,反应①在恒压条件下进行,平衡时SO2Cl2的转化率α2_____α1(填“>”、“<”或“=”)。若要增大SO2Cl2的转化率,可以采取的措施有______(列举一种)。
(4)锂亚硫酰氯(Li/SOCl2) 电池是一种大容量电池,该电池用锂与石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4) 溶解在亚硫酰氣(SOCl2)中形成的,其电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S。
①写出电池工作时正极的电极反应式_____________;
②若用此电池做电源,以铂作电极电解200mL 0.2mol.L-1CuSO4溶液,当两极各产生标准状况下896mL的气体时,电池负极消耗锂的质量是______g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列四个坐标图分别表示四个实验过程中某些量的变化,其中不正确的是( )

A. 向盐酸和氯化钙的混合溶液中加入碳酸钠 B. 向氢氧化钠溶液中加水
C. 双氧水分解 D. 向饱和氯化钠溶液中加水稀释
查看答案和解析>>
科目: 来源: 题型:
【题目】化学是一门以实验为基础的自然科学,用下列各装置或其组合能完成相应实验的是(已知实验室可用块状硫化亚铁(FeS)与稀硫酸反应制取硫化氢(H2S)气体)

A. 装置②⑦可用于制取并收集干燥的CO2
B. 装置①⑤可用于制取并收集氧气
C. 装置②⑥可用于制取并收集硫化氢(H2S)气体
D. 装置④装满水后可以收集并储存氧气,需要氧气时可用水将装置中的氧气排出,水应从b端通入
查看答案和解析>>
科目: 来源: 题型:
【题目】将8gNaOH固体溶于水配成500mL溶液,此溶液中NaOH的物质的量浓度为__mol/L;若取出10mL该溶液,则Na+的物质的量浓度为__mol/L,其中含NaOH的质量为____g;将这500 mL溶液浓缩成100mL后,NaOH的物质的量浓度为__mol/L,若所得溶液的密度为dg/mL,则该浓溶液溶质的质量分数为____________(蒸发过程中没有溶质析出)。
查看答案和解析>>
科目: 来源: 题型:
【题目】I. 常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
组别 | c(一元酸)或c(H+) | c(NaOH)/mol/L | 混合溶液的pH |
甲 | c(H+)=0.1 mol/L的HX酸 | 0.1 | pH=a |
乙 | c(HY)=0.1mol/L | 0.1 | pH=7 |
丙 | c(HZ)=0.1 mol/L | 0.1 | pH=9 |
(1)甲组实验中HX为弱酸,a______7(填“<”,“=”或“>”)。
(2)乙组实验中HY溶液的pH=______。
(3)丙组实验发生反应的离子方程式为__________________,
所得溶液中由水电离出的c(OH-)=______mol/L。
II. 将0.1 mol·L-1 NaOH溶液分别滴入体积均为20 mL、浓度均为0.1 mol·L-1 HCl溶液和HA溶液,溶液的pH随加入NaOH溶液体积变化如图:
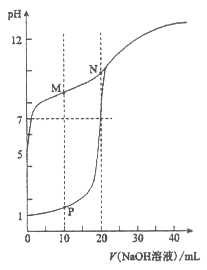
(1)HA为_______酸(填“强”或“弱”)。
(2)N点pH>7的原因是(用离子方程式表示)_________。
(3)下列说法正确的是_______ (填字母)。
a. M点c(HA)-)
b. M点c(Na+)>c(OH-)
c. P点c(Cl-)=0.05 mol·L-1
(4)NaA与NaOH等浓度等体积混合时,溶液中c(A-)______c(OH-)(填“<”,“=”或“>”)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)0.5mol (NH4)2S的质量为__g。
(2)标准状况下,1.7 g NH3与__LH2S气体含有的氢原子数相同。
(3)标准状况下,1.6g某气态氧化物RO2体积为0.56L,该气体的物质的量为__mol,RO2的相对分子质量为__。
(4)与0.2molH2含有相同电子数目的氦气分子的物质的量为_____。
(5)标准状况下, NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为____,该气体对氢气的相对密度为___,NH3的体积分数为____。
(6)同温同压下,等体积的CO和CO2的物质的量之比__,所含氧元素的质量比__。
查看答案和解析>>
科目: 来源: 题型:
【题目】钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
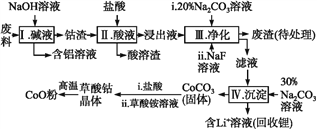
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表。
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是__________。
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:______。
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过______;废渣中的主要成分除了LiF外,还有______。
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是______。
(5)在空气中加热5.49 g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
①加热到210 ℃时,固体质量减轻的原因是__________。
②经测定,加热到210~290 ℃过程中的生成物只有CO2和钴的氧化物span>,此过程发生反应的化学方程式为___________。[已知M(CoC2O4·2H2O)=183 g·mol-1]
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,0.1mol Na2CO3与盐酸混合所得溶液的体积为1L,溶液中部分微粒浓度与pH 的关系如图所示。下列有关叙述正确的是

A. 随溶液pH增大,c(CO32-)/c(HCO3-)的值先减小后增大
B. 25℃时,碳酸的第一步电离常数Ka1=10-6
C. pH=4 的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)=0.1mol/L
D. b点所示的溶液中:c(Na+)+c(H+)= 2c(CO32-)+c(OH-)+c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中A到F是化合物,且A、B、E、F均含钠元素,G是单质.

(1)写出A、B、E、F的化学式:A________,B________,E________,F________.
(2)写出反应①②③的化学方程式:① _____________________________② _________________________________③__________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com