
科目: 来源: 题型:
【题目】下列叙述中,正确的是( )
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.得电子越多的氧化剂,其氧化性就越强
C.阳离子只有氧化性,阴离子只有还原性
D.有单质参加的反应不一定属于氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】四氯化钛(TiCl4)极易水解,遇空气中的水蒸汽即产生“白烟”,常用作烟幕弹。其熔点-25℃,沸点 136.4℃。某实验小组设计如下装置(部分加热和夹持装置省略),用Cl2与炭粉、TiO2制备TiCl4。下列说法不正确的是

A. ②、⑤中分别盛装饱和食盐水和NaOH溶液
B. 冷凝管有冷凝、回流和导气的作用
C. 反应结束时,应先停止③处加热,后停止①处加热
D. 该设计存在不足,如④⑤之间缺少防水蒸汽进入④的装置
查看答案和解析>>
科目: 来源: 题型:
【题目】吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断Na2SeO3的作用是( )
A.作还原剂
B.作氧化剂
C.既作氧化剂又作还原剂
D.既不作氧化剂又不作还原剂
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示为盐酸介质中,金属铜与氢叠氮酸(HN3)构成的原电池,总反应方程式为: 2Cu+2Cl- +HN3+3H+=2CuCl(s)+N2↑+NH4+。下列叙述错误的是
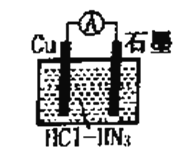
A. 电子的流向为Cu→![]() →石墨
→石墨
B. 负极的电极反应式为Cu+Cl――e-=CuCl(s)
C. 反应一段时间后正极区溶液的pH减小
D. 标准状况下,生成224mL N2时,铜转移的电子数为0.02NA
查看答案和解析>>
科目: 来源: 题型:
【题目】以有机化合物A为初始原料,合成有机化合物C和F的路线如图所示:
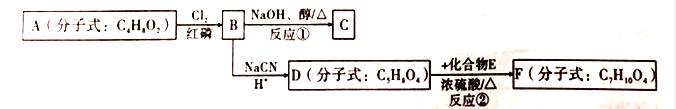
已知以下信息:
①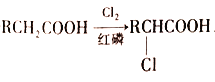 ,R-Cl
,R-Cl![]() R—COOH,其中R表示烃基;
R—COOH,其中R表示烃基;
②D的核磁共振氢谱有两种不同化学环境的氢;
③F为七元环状化合物。
回答下列问题:
(1)A中含有的官能团名称为________;1molA完全燃烧消耗O2________mol.
(2)判断反应类型:反应①为_________;反应②为_________。
(3)E的结构简式为_________;F的结构简式为_________。
(4)由B生成C的化学方程式为_________。
(5)请写出满足下列条件的D的2种链状同分异构体的结构简式: _________。
①可发生水解反应;②核磁共振氢谱显示有两组峰,且峰面积之比为1:3。
(6)利用该合成路线中的有关信息,写出以乙醇为初始原料,其他无机试剂任选,制备有机化合物CH2=CHCOOH的合成路线流程图:(流程图示例:CH3CH2OH![]() H2C=CH2
H2C=CH2![]() BrH2C—CH2Br)________________
BrH2C—CH2Br)________________
查看答案和解析>>
科目: 来源: 题型:
【题目】根据最新报道,贵州发现超大型锰矿,整个矿区资源量超两亿吨。锰矿是继铁矿、铝矿之后,排在第三位的金属矿产,属国家战略紧铁矿产之一,在电池、磁性新材料等方面都有广泛应用。中国是全球最大的锰矿石和锰系材料生产、清费大国,回答下列问题:
(1)基态锰原子的价层电子排布式为_________。
(2)铜锰氧化物(CuMn2O4) 能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
①CO 和N2 互为等电于体。CO 分子中σ键和π键数目之比为________。
②HCHO分子的H-C-H 键角______(填“大于”“小于”或“等于”)CO2的键角,理由是__________。
③ 向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶被中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。CO32-的空间构型是____________。
(3)晶体熔点: Fe2O3晶体______Al2O3晶体(填“>”“<”或“=”),理由是___________。
(4)锰、铁的第三电离能(I3) 较大的是_______(填素符号)。
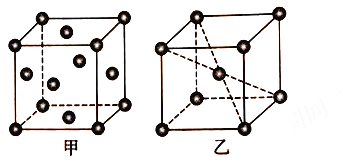
(5) 铝晶胞如图26甲所示。铝晶胞中,铝原子的配位数为________。已知铝的晶体密度为ρ g·cm-3,N A代表阿伏加德罗常数的值,设铝原子的半径为rpm,则r=_______。
(6)锰晶胞如图乙所示。已知锰晶胞参数为a nm。设锰晶胞中两个锰原子核之间最短距离为dnm,则d=_____。锰晶胞中Mn 的空间利用率φ=____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某原电池构造如图所示,下列叙述正确的是( )

A. 在外电路中,电子由银电极流向铜电极
B. 取出盐桥后,电流表的指针仍发生偏转
C. 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g
D. 原电池的总反应式为Cu+2AgNO3===2Ag+Cu(NO3)2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.1869年门捷列夫制作第一张周期表的根据是依据原子序数,这在当时有重要意义。
B.周期表中有七个主族,八个副族,一个0族。18个纵行,共16个族。
C.短周期元素是指1~20号元素。
D.周期表中有七个周期。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是
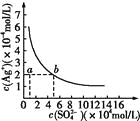
A. 含有大量SO42-的溶液中肯定不存在Ag+
B. 0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
C. Ag2SO4的溶度积常数(Ksp)为1×10-3
D. a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
查看答案和解析>>
科目: 来源: 题型:
【题目】NO2、NO、CO、NO2-等是常见大气污染物和水污染物,研究NO2、NO、CO、NO2-等的处理对建设美丽中国具有重要意义。
已知:①NO2+CO![]() CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②![]() N2(g)+
N2(g)+ ![]() O2(g)
O2(g)![]() NO(g) △H=+89.75kJ/mol,K2
NO(g) △H=+89.75kJ/mol,K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol,K3
2NO2(g) △H=-112.3kJ/mol,K3
写出NO与CO反应生成无污染气体的热化学方程式:_____________,此热化学方程式的平衡常数K=_______(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=_______。若此温度下,某时刻则得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围为________。
,则反应开始到平衡时CO的平均反应速率v(CO)=_______。若此温度下,某时刻则得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围为________。
(3)研究发现:NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-1810kJ/mol
①相同条件下,在2L恒容密闭容器中,选用不同的催化剂,上述反应产生N2的物质的量随时间变化的情况如图所示。
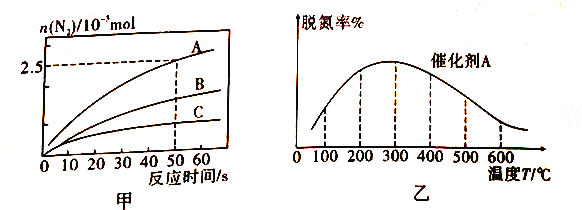
a.在催化剂A作用下,反应达到平衡的标志是_____(填序号)。
A.4v(NH3)正=6v(H2O)逆
B.容器内总压强不再改变
C.容器内密度不再改变
D.NO 和H2O(g)浓度相等
E.容器内平均摩尔质量不再改变
b.在A、B,C 三种催化剂下,清除氮氧化物反应的活化能分别表示为Ea(A)、Ea(B)、Ea(C),根据图甲所示曲线,判断三种催化剂条件下,活化能由大到小的顺序为________。
②在氨气足量时,反应在催化剂A 作用下,经过相同时间,测得脱氮潮殖反应温度的变化情况如图乙所示,据图可知,自相同的时间内,温度对脱氮率的影响及可他的原因是________。(已知A、B催化剂在此温度范围内不失效)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com