
科目: 来源: 题型:
【题目】亚硝酰氣(ClNO)常用作催化剂和合成洗涤剂,其沸点为-5.5℃,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,进行如下实验(夹持装置略去)。请回答:

Ⅰ.Cl2的制备
(1)Cl2的发生装置可以选择上图中的____________(填大写字母),反应的离子方程式为__________.
(2)欲收集一瓶干燥的氯气,选择上图中的装置,其连接顺序为:a![]() _____(按气流方向,用小写字母表示)。
_____(按气流方向,用小写字母表示)。
Ⅱ.亚硝酰氯(ClNO)的制备。实验室可用下图装置制备亚硝酰氯(ClNO);
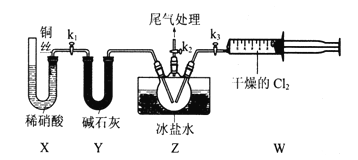
(3)实验室也可用B装置制备NO,与之相比X装置的优点为_______.
(4)在检查完装置气密性,并装入药品后,打开k2,然后再打开________(填“k1”"或“k3”),通入一段时间气体,其目的为_________。接下来,两种气体在Z中反应,当有一定量液体生成时,停止实验。
Ⅲ.亚硝酰氯(ClNO)纯度的测定
取Z中所得液体mg溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4。溶液为指示剂,用c mol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。(已知:Ag2CrO4为砖红色固体)
(5)亚硝酰氯(ClNO)与水反应的化学方程式为___________.
(6)亚硝酰氯(ClNO)的质量分数为_________(用代数式表示即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A. 分子的结构是由键角决定的
B. H2O分子中的两个O—H键的键角为180°
C. CF4、CCl4、CBr4、CI4中C—X键的键长、键角均相等
D. 共价键的键能越大,共价键越牢固,由该键形成的分子越稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】aLCO2气体通过足量Na2O2后,所得气体再与bLNO混合时,可得到cL气体(气体体积均在相同状况下测定),下列表达式中,错误的是( )
A. 若a则c<![]() (a+b) B. 若a则c>
(a+b) B. 若a则c>![]() (a+b)
(a+b)
C. 若a>b则c=![]() (a+b) D. 若a=b则c=
(a+b) D. 若a=b则c=![]() (a+b)
(a+b)
查看答案和解析>>
科目: 来源: 题型:
【题目】现有镁、铝合金5.1g完全溶于稀盐酸中,在标准状况下共收集到氢气5.6L,计算:
(1)氢气的物质的量是 。
(2)双线桥法表示出铝和盐酸反应的电子转移的方向和数目?
(3)求这种合金中镁、铝的物质的量分别是多少?
查看答案和解析>>
科目: 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。
则下列有关比较中正确的是( )
A. 电负性:④>③>②>① B. 原子半径:④>③>②>①
C. 第一电离能:④>③>②>① D. 最高正化合价:④>③=②>①
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于苯的叙述中正确的是
A.苯的结构中存在碳碳单键和碳碳双键
B.将苯加到溴水中,振荡、静置,上层几乎无色,下层为橙红色
C.苯分子中6个碳碳键完全相同
D.苯在催化剂作用下可以与液溴发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】已知物质A~I之间的转化关系符合下图所示.其中A、C、F、G、I为常见固体且焰色反应均为黄色;A为海水中主要溶质,B为常温下常见液体;E为黄绿色气体,H是无色无味且能使澄清石灰水变浑浊的气体.
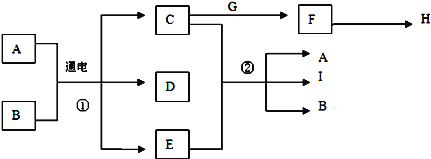
试回答下列问题:
(1)D的化学式为__________。
(2)反应①的化学方程式为:____________________________。
(3)反应②的离子方程式为:____________________________。
(4)写出镁条在H气体中燃烧的反应方程式为:___________________________。
(5)G在水中的电离方程式_____________________________。
(6)在A、I和B的混合物中加入稀硫酸,有黄绿色气体产生,写出该反应的化学方程式_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、为探究CO2与过量的NaOH溶液确实发生了化学反应,甲、乙、丙三位同学设计了下列三种实验装置,请回答下列问题:
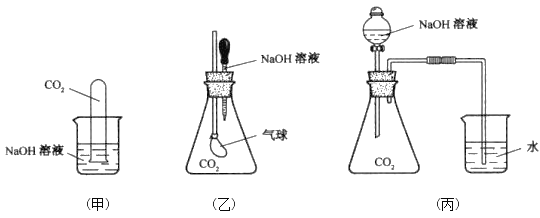
(1)请写出甲实验中CO2与过量的NaOH发生反应的离子方程式:__________。
(2)丙实验装置的实验现象是________________________。
(3)乙实验中,如果二氧化碳和氢氧化物的物质的量之比为1:1.5,且恰好完全反应,溶液中含有的溶质主要是_______________。
A、NaOH 和Na2CO3 B、Na2CO3 C、Na2CO3和NaHCO3 D、NaHCO3
Ⅱ、为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图:
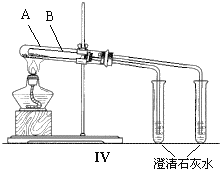
(1)小试管B中应装的药品是________(写化学式)。
(2)和大试管A相连的装有澄清石灰水的小试管中出现的现象预计是____________________。
Ⅲ、工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:沉淀分析法
(1)称取质量为m1 g的样品溶解后加入过量的CaCl2溶液,将所得沉淀______________(填操作)、洗涤、烘干、称量得到m2 g固体,则Na2CO3的质量分数是_____________________。
方案二:气体分析法
(2)把一定量的样品与足量盐酸反应,用下图所示装置测定产生CO2的体积,实验结束后,量筒中得到V mL液体,则反应中生成二氧化碳的物质的量是____________(题目中气体体积均已经换算成标准状况),为了确保测定结果的准确性,B中的溶液为饱和碳酸氢钠,因为二氧化碳难溶于饱和碳酸氢钠,但选用该溶液后实验结果仍然不够准确,Na2CO3的质量分数偏大,其原因可能是___________。
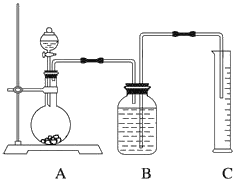
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com