
科目: 来源: 题型:
【题目】现有浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水.请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)___________。
(2)④、⑤、⑥、⑦四种溶液中NH![]() 浓度由大到小的顺序是(填序号)_______________。
浓度由大到小的顺序是(填序号)_______________。
(3)将③和④按体积比1∶2混合后,混合液中各离子浓度由大到小的顺序是:__________________。
(4)已知t ℃时,KW=1×10-13,则t ℃(填“>”、“<”或“=”)________25℃。在t ℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于氦原子电子云图的说法正确的是( )
A. 通常用小黑点来表示电子的多少,黑点密度大,电子数目大
B. 黑点密度大小,表示单位体积内电子出现的机会多少
C. 通常用小黑点来表示电子绕核作高速圆周运动
D. 电子云图是对运动无规律性的描述
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应: Co2O3 + 6HCl(浓)= 2CoCl2+ Cl2↑ + 3H2O 。下列说法正确的是
A. HCl是氧化剂
B. Cl2被氧化,发生氧化反应
C. 还原性:CoCl2 > HCl
D. 该反应生成标准状况下11.2L Cl2,转移NA个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】抗结肠炎药物有效成分M的合成路线如下(部分反应略去试剂和条件):
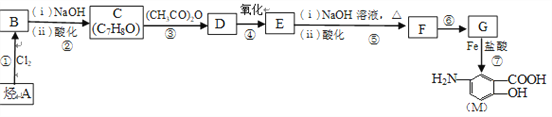
已知:
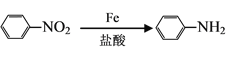
(1)烃A的结构简式是__________,G中的官能团名称是__________。
(2)反应①的反应条件是_________,反应⑥的反应类型是__________。
(3)下列对抗结肠炎药物有效成分M可能具有的性质推测正确的是________(填字母)。
A.既有酸性又有碱性 B.能发生消去反应
C.能发生加聚反应 D.1mol M与足量溴水充分反应,最多消耗1molBr2
(4)E与足量NaOH溶液反应的化学方程式是_______________________。
(5)写出符合下列条件的D的同分异构体的结构简式(任写一种)__________。
①属于芳香族化合物且苯环上有3个取代基
②能和NaHCO3溶液反应产生气体
③核磁共振氢谱有4组峰且峰面积之比为6∶2∶1∶1
(6)M在一定条件下可以发生缩聚反应生成含肽键的高分子化合物,写出该反应的化学方程式:_______________________________________________________
(7)已知:①![]() 易被氧化,②苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位。③苯环上连有羧基时再引入一个取代基,常取代在羧基的间位。参照以上的合成路线,设计一条以A为原料合成化合物
易被氧化,②苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位。③苯环上连有羧基时再引入一个取代基,常取代在羧基的间位。参照以上的合成路线,设计一条以A为原料合成化合物![]() 的合成路线。_______
的合成路线。_______
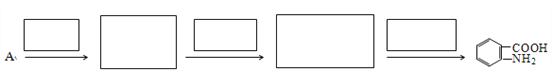
查看答案和解析>>
科目: 来源: 题型:
【题目】在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气, 放出256.64kJ的热量。
(1)写出该反应的热化学方程式
(2)已知H2O (l) = H2O(g) △H= + 44 kJ·mol-1,则16g液态肼燃烧生成氮气和液态水时,放出的量是 kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的 优点
(4)已知N2(g)+2O2(g)=2 NO2(g) △H= +68 kJ·mol-1, N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式
查看答案和解析>>
科目: 来源: 题型:
【题目】I.汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务。汽车内燃机工作时发生反应:N2(g)+O2(g)![]() 2NO(g),该反应是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5 mol N2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
2NO(g),该反应是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5 mol N2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
(1)5 min内该反应的平均速率v(NO)=___________;在T℃时,该反应的平衡常数值为_________。
(2)反应开始至达到平衡的过程中,容器中下列各项发生变化的是(填序号)___________。
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
(3)已知:ⅰ.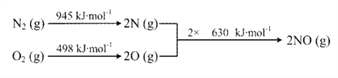
ⅱ. N2(g) + 2O2(g) === 2NO2(g) ΔH= + 68 kJ·mol-1
结合热化学方程式,说明温度对于NO生成NO2平衡转化率的影响:_____________________。
II. 含pm2.5的雾霾主要成分有SO2、NOx、CxHy及可吸入颗粒等。
(4)雾霾中能形成酸雨的物质是_____________
(5)NaClO2溶液可以吸收SO2、NO。在NaClO2溶液中通入含有SO2和NO的气体,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式________________________
增大压强,NO的转化率______(填“提高”“不变”或“降低”)。
②由实验结果可知,脱硫反应速率大于脱硝反应速率(填“大于”或“小于”)。原因除了SO2溶解性大于NO,还可能是___________________
(6)如图电解装置可将SO2、NO转化为(NH4)2SO4,
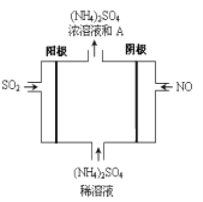
①阴极的电极反应式是______________________________
②SO2、NO通入电解装置中的体积比为___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法不正确的是
A. 1mol过氧化钠与水完全反应,转移电子数为NA
B. 46g NO2与N2O4混合气体中含有原子数为3NA
C. 标准状况下,11.2LCCl4含有的分子数为0.5 NA
D. 含有0.1 NA个CO32-的Na2CO3固体的质量为10.6g
查看答案和解析>>
科目: 来源: 题型:
【题目】捕集、利用CO2是人类可持续发展的重要战略之一。
(1)用太阳能工艺捕获CO2可得炭黑,其流程如图所示:

①捕获1mo1CO2转移电子的物质的量是_________。
②过程2反应的化学方程式是________。
(2)将CO2催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g),按投料比n(CO2):n(H2)=1:3将CO2与H2充入密闭容器,在0.1MPa时,测得平衡时四种气态物质,其温度(T)与物质的量(n)的关系如图所示。
C2H4(g)+4H2O(g),按投料比n(CO2):n(H2)=1:3将CO2与H2充入密闭容器,在0.1MPa时,测得平衡时四种气态物质,其温度(T)与物质的量(n)的关系如图所示。

①正反应的焓变△H_________0。
②提高CO2的转化率,可采用的方法是______。
a.增大n(CO2)与n(H2)的投料比
b.改变催化剂
c.缩小容器体积
③图中表示水的曲线是_____。
(3)电解CO2可制得多种燃料:下图是在酸性电解质溶液中,以惰性材料做电极将CO2转化为丙烯的原理模型。

①太阳能电池的正极是________。
②生成丙烯的电极反应式是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①②③三种不同的环境中

请回答:
(1)金属腐蚀主要分为__________腐蚀和_____________腐蚀两种。
(2)铁被腐蚀的速率由快到慢的顺序是_________________(填序号)。
(3)①中正极的电极反应式为_________________________________________________,②中负极的电极反应式为_________________________________________。
(4)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防护金属被腐蚀可采取的措施有__________(填序号)。
①健身器材刷油漆 ②自行车钢圈镀铬
③将钢管用导线与铜条连接 ④将钢管用导线与碳棒连接
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com