
科目: 来源: 题型:
【题目】已知:乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式_____________________________________ 。
(2)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH______________ (填“大”、“小”或“相等”) 。
(3)常温下将0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为_____________________________________ 。
(4)往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为________________。
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入c mol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A.核外电子排布完全相同的两种粒子,其化学性质一定相同
B.难失电子的原子,一定具有强氧化性
C.离子化合物和共价化合物中都可能含有非极性键
D.共价化合物溶水电离过程中,共价键未被破坏
查看答案和解析>>
科目: 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法是还原沉淀法。该法的工艺流程为:
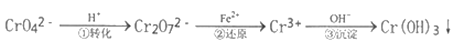
已知:CrO42-(黄色)、Cr2O72- (橙色)
(1)用离子方程式表示第①步可逆反应转化过程___________________。
(2)用离子方程式表示第②步还原反应转化过程___________________。
(3)能说明第①步反应达平衡状态的是_________。
a.Cr2O72-和CrO42-的浓度不变 b.2V(Cr2O72-) =V(CrO42-) c.溶液的颜色不变
(4)第②步中,还原1.5mol Cr2O72-离子,需要_______mol的FeSO47H2O。
(5)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr (OH)3 (s)![]() Cr3+ (aq) +3OH- (aq)。常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-) = 10-32,要使0.01mol/Lc(Cr3+)开始沉淀,溶液的pH应调至__________,若使c(Cr3+)降至10-5mol/L,溶液的pH应调至___________。
Cr3+ (aq) +3OH- (aq)。常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-) = 10-32,要使0.01mol/Lc(Cr3+)开始沉淀,溶液的pH应调至__________,若使c(Cr3+)降至10-5mol/L,溶液的pH应调至___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用碳酸钠晶体(Na2CO3·10H2O)配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1)本实验用到的仪器除托盘天平、烧杯、玻璃棒、胶头滴管外还需要______________,应称取Na2CO3·10H2O晶体的质量为________克。
(2)下列操作中,容量瓶所不具备的功能有________。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体 D.用来加热溶解固体溶质
(3)配制0.2 mol·L-1的Na2CO3溶液480 mL的主要步骤有:①溶解 ②计算 ③转移洗涤 ④定容摇匀 ⑤称量;正确的操作顺序是:_____________________。(填序号)
(4)根据下列操作对所配溶液浓度偏高的有(填序号)____________。
①碳酸钠晶体失去了部分结晶水 ②用“左码右物”的称量方法称量晶体
③碳酸钠晶体不纯,其中混有氯化钠④定容时俯视
⑤容量瓶未经干燥就使用 ⑥定容摇匀后,发现]液面低于刻度线,再加水到刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】高压电机,复印机工作时会产生臭氧,该气体有强氧化性。下列叙述不正确的是( )
A、臭氧和氧气互为同素异形体 B、臭氧可使KI淀粉试纸变蓝
C、臭氧的存在对人体有益无害 D、臭氧是很好的消毒剂和脱色剂
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
(1)有一种溶液,除含H+、OH- 外,还含有Na+、SO42- 和Cl-,测得Na+、SO42- 和Cl-三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH近似为____________。
(2)NH4Cl溶液显酸性,试用离子方程式表示这一原理______________ 。
(3)液氨的电离类似于水,试写出液氨的电离方程式_______________;在液氨中加入NH4Cl,平衡将向_________移动。
(4)氯化银在水中存在沉淀溶解平衡: AgCl(s)![]() Ag+(aq)+Cl-(aq), 在25℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL 0.1 mol·L-1氯化镁溶液中;②100 mL蒸馏水中;③100 mL 0.1 mol·L-1硝酸银溶液中;④100 mL 0.1 mol·L-1盐酸溶液中。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是____________(填写序号)。
Ag+(aq)+Cl-(aq), 在25℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL 0.1 mol·L-1氯化镁溶液中;②100 mL蒸馏水中;③100 mL 0.1 mol·L-1硝酸银溶液中;④100 mL 0.1 mol·L-1盐酸溶液中。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是____________(填写序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用图中所示装置进行实验,实验现象与预测不一致的是( )
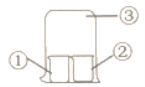
①中的物质 | ②中的物质 | 预测现象 | |
A | 饱和亚硫酸 | 蓝色石蕊试液 | ②中溶液先变红色又褪色 |
B | 饱和氯水 | 湿润红纸条 | ②中红纸条褪色 |
C | 浓双氧水 | H2S溶液 | ②中有淡黄色沉淀 |
D | 浓氨水 | 浓盐酸 | ③中有白烟 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_______(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) ____________c(CH3COO-)(填“ >”或“=”或“<” )。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5。写出MOH的电离方程式:__________________。
(3) 99 ℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。此时水的离子积Kw=________,水电离出的c(H+)=________,而此时溶液中的c(Na+)__________ c(SO42-)(填“>”“=”或“<”)。
(4)相同温度下等物质的量浓度的下列溶液中
A.NH4C1 B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
①pH值由大到小的顺序是__________(用对应的字母填写)。
②NH4+离子浓度由大到小的顺序是__________(用对应的字母填写)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com