
科目: 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
A.工业上可用铝热反应大规模炼铁
B.SO2常用于纸张等植物纤维的漂白
C.Si是重要的半导体材料
D.电解熔融MgCl2 , 可制得金属镁
查看答案和解析>>
科目: 来源: 题型:
【题目】根据有关知识回答下列问题
(1)25℃时,0.1 molL-1的一元酸HA溶液中c(H+)=1.0×10-4 molL-1,请回答下列问题:此时溶液的pH=_______,HA是________酸(填“强”或“弱”)。
(2)现有NaHCO3、NaHSO3、NaHSO4三种常见的酸式盐,它们在工业生产和日常生活中有着广泛的应用。请回答有关问题:
①25℃时,NaHCO3的水溶液显_____性(填“酸”或“碱”)。
②25℃时,物质的量浓度均为0.01 molL-1的三种酸式盐溶液,pH最小是_________。
(3)向50ml 0.018molL-1的AgNO3溶液中加入50m1 0.020molL-1的盐酸生成AgCl沉淀。已知该温度下Ksp(AgCl)=1.0×10﹣10,忽略溶液的体积变化,完全沉淀后,溶液中c(Ag+)=__molL-1。
(4)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(杂质不参与反应)。
实验步骤:准确称取1g Na2C2O4固体样品,配制成100mL溶液,取出20.00mL于锥形瓶中。再向锥形瓶中加入足量稀H2SO4溶液,用0.016 molL-1高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。
(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
①高锰酸钾溶液应装在_______滴定管中.(填“酸式”或“碱式”)。
②滴定至终点时的实验现象是:__________________________________________。
③下列操作可能使测量结果偏高的是__________。
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算样品中Na2C2O4的纯度______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(Ⅰ)有以下10种物质:①液态氯化氢、②CCl4、③液氯、④硫酸铵晶体、⑤铁、⑥稀硫酸、⑦澄清石灰水、⑧二氧化硫,⑨熔融的硫酸钠、⑩Na2O固体。其中属于电解质的是_______(填序号,下同),属于非电解质的是_________,在现状态下能导电的是__________,写出④在水溶液中电离的方程式__________。
(Ⅱ)A、B、C是三种元素的原子,质子数都小于18。A原子与B原子的最外层电子数都是6,A原子与C原子的核外电子层数都为3, C原子的质子数比A少4。回答下列问题:
(1)C的离子结构示意图为_________;
(2)元素A的一种质量数为32的核素,与元素B的一种核素构成微粒为AB42-,1mol AB42-的质量为104g,则元素B的该核素中的中子数为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中,C1-的物质的量浓度最大的是
A.300 mL0.1 mol/L NaCl溶液
B.100 mL0.1 mol/LFeCl3溶液
C.标准状况下,4.48LHC1气体溶于水配成的1 L溶液
D.向1 L0.2 mol/L BaCl2溶液中加入0.2 mol/L的H2SO4溶液到沉淀恰好完全时的溶液(忽略溶液混合时的体积变化)
查看答案和解析>>
科目: 来源: 题型:
【题目】CH4、CO2和碳酸都是碳的重要化合物,实现碳及其化合物的相互转化,对开发新能源和降低碳排放意义重大。
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1kJmol—1
CO(g)+3H2(g) △H1=+206.1kJmol—1
②2H2(g)+CO(g)![]() CH3OH(l) △H2=-128.3kJmol—1
CH3OH(l) △H2=-128.3kJmol—1
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJmol—1
写出由甲烷和氧气合成液态甲醇的热化学方程式:_____________________。
(2)若利用反应①来制备氢气。为了探究温度、压强对反应①的影响,设计以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ mol·L—1 | H2O初始浓度/ mol·L—1 |
1 | 400 | 101 | 3.0 | 7.0 |
2 | T | 101 | 3.0 | 7.0 |
3 | 400 | P | 3.0 | 7.0 |
Ⅰ、实验1、实验2和实验3比较,反应开始时正反应速率最快的是_________;平衡时CH4的转化率最小的是_________。
Ⅱ、实验2和实验3相比,其平衡常数关系:K2______K3(填“>”、“<”或“=”)。
(3)科学家提出由CO2制取碳(C)的太阳能工艺如图1所示.
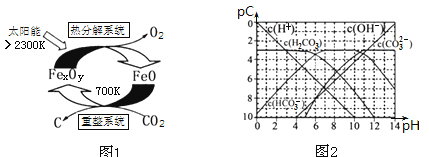
①“重整系统”发生的反应中n(FeO)∶n(CO2)=6∶1,则FexOy的化学式为______;
②“热分解系统”中每分解l mol FexOy,同时生成标准状况下气体体积为_______。
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。如某溶液中溶质的浓度为1×10—2molL—1,则该溶液中溶质的pC=﹣lg(1×10—2)=2。上图2为25℃时H2CO3溶液的pC﹣pH图。请回答下列问题:
①
②在8<pH<10时,溶液中HCO3—的pC值不随着pH增大而减小的原因是____;
③求H2CO3一级电离平衡常数的数值Ka1= _______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图,电源A是氢氧燃料电池(电解质溶液为KOH溶液),B为浸透饱和氯化钠溶液的pH试纸,甲为电解池。请填空:
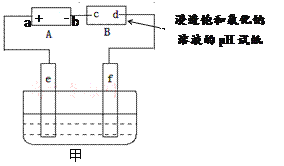
(1)电源A中a极应通入的气体是______,b极上发生的电极反应是_______________。
(2)通电后,试纸上c极称为_____极,实验中发现该极周围pH试纸变蓝色,原因是_____(结合电极反应式说明)。
(3)实验中d极周围可能观察到的现象是的______________________________。
(4)①若利用甲实现铁上镀锌,应将铁接_________极(填“e”或“f”);
②若利用甲实现粗铜的精炼,f电极上的反应是_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环,有效降低碳排放。
(1)在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJmol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJmol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
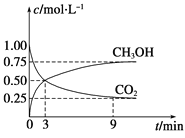
①计算:从0min到3min,H2的平均反应速率v(H2)=_______mol·L-1·min-1,反应至平衡时,放出的热量是_______kJ。
②能说明上述反应达到平衡状态的是________(填编号)。
A.c(CO2) ∶c(CH3OH)=1∶1
B.混合气体的密度不再发生变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③反应达到平衡后,保持其他条件不变,能加快反应速率且使体系中气体的物质的量减少,可采取的措施有________(填编号)。
A.升高温度 B.缩小容器体积
C.再充入CO2气体 D.使用合适的催化剂
(2)已知A(g)+B(g) ![]() C(g)+D(g) ΔH,反应的平衡常数和温度的关系如下:
C(g)+D(g) ΔH,反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | x | 0.6 | 0.4 |
回答下列问题:
①该反应是_____反应(填“放热”或“吸热”)。
②830℃时,向一个2L的密闭容器中充入0.20mol的A和0.80mol的B,反应至10s时达到平衡,测得A的转化率为80%,计算830℃时,反应的平衡常数x=____。
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL、2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答:
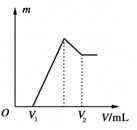
(1)若在滴加NaOH溶液的过程中沉淀质量m随加入NaOH溶液的体积V变化如上图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=________ mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________ mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL、2 mol·L-1的H2SO4溶解此混合物后,再加入450 mL、1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一。
(1)反应A(g)+B(g)=C(g)+D(g),反应过程中能量变化如下图所示,回答下列问题:

①化学反应中产生能量变化的本质原因是______________;
②该反应是_____反应(填“吸热或放热”)、ΔH=__________ (用E1、E2表示);
③加入催化剂对该反应的ΔH是否有影响?___________。
(2)已知:一定条件下,拆开1molH-H键、1molCl-Cl键、1molH-Cl键需要的能量分别是436kJ、243kJ、432kJ,则反应H2(g)+Cl2(g)=2HCl(g) 的ΔH=_____。
(3)已知:2CH3OH(l)+2O2(g)=2CO(g)+4H2O(g) ΔH1=-a kJmol﹣1
2CO(g)+O2(g)=2CO2(g) ΔH2=-b kJmol﹣1
H2O(g)=H2O(l) ΔH3=-c kJmol﹣1
则表示CH3OH(l)燃烧热的热化学方程式为_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com