
科目: 来源: 题型:
【题目】为了探究氨气及氨水的还原性,某兴趣小组同学设计了以下探究活动。
I.探究氨气的还原性
该兴趣小组同学利用以下装置(夹持,加热仪器略)探究氯气与氨气的反应,其中A、F分别为氯气和氨气的发生装置,B为纯净干燥的氯气与氨气反应的装置。
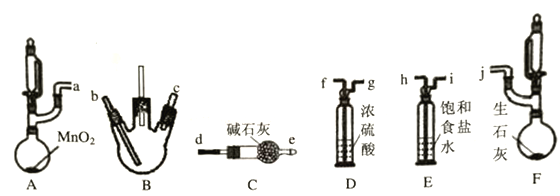
请回答下列问题:
(1)上述装置接口的连接顺序为a接h、i接f、g接___、____接___、____接j,其中装置D的作用是____________。
(2)若氨气足量,装置B中出现的现象为____________。
II.探究氨水的还原性
该兴趣小组同学探究不同条件下高锰酸钾溶液与氨水的反应,实验如下:
实验 | 操作 | 现象 |
① | 取2mL.0.01mol/LKMnO4溶液于试管中,加入新开封1mL浓氨水,加入半滴管蒸馏水,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),约10min后溶液紫红色变浅 |
② | 取2mL0.01mol/LKMnO4溶液于试管中,加入新开封1mL浓氨水,加入半滴管1:5的硫酸,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),溶液紫红色立刻变浅,约2min后溶液紫红色完全退去 |
③ | 取2mL0.1mol/LKMnO4溶液于试管中,加入新开封ImL浓氨水,加入半滴管蒸馏水,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),约10min后溶液紫红色变浅 |
④ | 取2mL0.1mol/LKMnO4溶液于试管中,加入新开封1mL浓氨水,加人半滴管1:5的硫酸,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),溶液紫红色立刻变浅,约5min后溶液紫红色完全退去 |
(3)实验①中氧化产物为N2,写出该反应的离子方程式:_________。
(4)实验①②说明________________。
(5)实验②比实验④反应速率_____(填“快“或“慢”),原因是_________。
(6)1:5的硫酸溶液(密度为ρ2g·cm-3),可用质量分数为98%的浓硫酸(密度为ρ1g·cm-3)和
蒸馏水按体积比1:5配成,则该1:5的硫酸溶液的物质的量浓度为_____mol/L。(用含ρ1、ρ2的式子表示)
(7)由实验I、II可得出的结论是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O══ 2AlO2—+3H2↑
B. AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C. 三氯化铁溶液中加入铁粉![]()
D. FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
步骤1:向2 mL 0.005 mol/LAgNO3溶液中加入2 mL 0.005 mol/LKSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。 | 溶液变为红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol/LAgNO3溶液。 | 现象a,且溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3mol/L KI溶液。 | 出现黄色沉淀。 |
已知:25℃,Ksp(AgI,黄色)= 8.3×1017 ,Ksp (AgSCN,白色 )= 1.0×1012 。
回答下列问题:
(1)步骤3中现象a是________________________________。
(2)用沉淀溶解平衡原理解释步骤4的实验现象________________。
(3)向50 mL 0.005 mol/L的AgNO3溶液中加入150 mL0.005 mol/L的 KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为_____mol/L 。
查看答案和解析>>
科目: 来源: 题型:
【题目】“保护环境”是我国的基本国策之一.下列做法不应该提倡的是( )
A.采取低碳、节俭的生活方式
B.严禁排放未经处理的有毒工业废水
C.经常使用一次性筷子、塑料袋等
D.按照规定对生活废弃物进行分类放置
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物A(C9H12O)是一种芳香醇,它不能被Cu催化氧化,可用于医药及香料的合成。A有如下转化关系。请回答下列问题。

已知:
①
②R1COCH3+R2CHO![]() R1COCH=CHR2+H2O
R1COCH=CHR2+H2O
(1)A的结构简式为________。
(2)B→D与H→I的反应类型分别为_____、______。
(3)F中的含氧官能团有_______。(写名称)
(4)若J为含有3个六元环的酯,则H→J反应的化学方程式为__________。
(5)下列关于物质K的说法正确的是(______)
A.K的化学式为C14H12O
B.能使酸性高锰酸钾溶液褪色
C.1mol的K与H2完全加成需要7mol的H2
D.K分子中所有原子可能在同一平面上
(6)H的同分异构体中,符合下列要求的同分异构体有______种。
①能与FeCl3溶液发生显色反应,且能与NaHCO3溶液反应;
②核磁共振氯谱显示有4种不同化学环境的氢,峰面积比为1:1:2:6。
(7)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成线路,设计一条由叔丁基氯(C(CH3)3Cl)和糠醛(
)是一种重要的医药中间体,请参考上述合成线路,设计一条由叔丁基氯(C(CH3)3Cl)和糠醛(![]() )为原料制备糠叉丙酮的合成线路(无机试剂任选)。__________
)为原料制备糠叉丙酮的合成线路(无机试剂任选)。__________
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)福州大学王新晨教授以氨基氰(CH2N2)为原料制得类石墨相氮化碳(g-C3N4),其单层结构如图1。

①氨基氰CH2N2)分子中C、N原子均满足8电子稳定结构,则该分子的结构式为______;该分子为______(填“极性”或“非极性”)分子。
②氨基氰易溶于水或乙醇,其主要原因是_____________。
③关于g- C3N4的叙述正确的是_________。
A.电负性:C>N B.该物质的熔点比石墨更高
C.该物质属于原子晶体 D.该物质中C和N原子均采取SP2杂化
(2)NH3与Zn2+可形成[Zn(NH3)6]2+离子,部分结构如图2。

①NH3的空间构型为_________。
②[Zn(NH3)6]2+离子中存在的化学键类型有______;NH3分子中H-N-H键角为107.3°,判断[Zn(NH3)6]2+离子中H-N-H键角______107.3°(填">”、"<”或“=”)。
③肼(N2H4)可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。与N2H4互为等电子体的分子有_______。(写一种)
(3)N元素形成的简单离子N3-与Xn+形成的晶体的是立方体结构,边长为anm,如图3所示。

①Xn+中所有的电子恰好充满K、L、M三个电子层,则基态X原子的价电子的轨道表示式为________。
②已知该晶体的密度为5.84g·cm-3,则阿伏加德罗常数NA的计算表示式为_____(含a)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示实验为“套管实验”,小试管内塞有沾有白色无水硫酸铜粉末的棉花球。
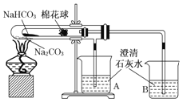
(1)点燃酒精灯加热,能观察到的实验现象是___________________________________。
(2)由上述实验你能得出的结论是_________________________________________。
(3)写出碳酸氢钠受热分解的化学方程式_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述错误的是
A.通常情况下,甲烷和强酸、强碱、强氧化剂不起反应
B.等物质的量的甲烷与氯气发生取代反应,产物中一氯甲烷的物质的量最多
C.甲烷的氯代物都难溶于水
D.光照下甲烷与氯气发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com