
科目: 来源: 题型:
【题目】将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是

A. Mg和Al的总质量为9g
B. 最初20mLNaOH溶液用于中和过量的稀硫酸
C. NaOH溶液物质的量浓度为5mol·L-1
D. 生成的氢气在标准状况下的体积为11.2L
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OCH3(g)+H2O(g)=2CH3OH(g)ΔH2=+23.4 kJ·mol-1
(1)反应2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH3=________kJ·mol-1。
CH3OCH3(g)+3H2O(g) ΔH3=________kJ·mol-1。
(2)一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是________(填字母)。
a.正反应速率先增大后减小 b.H2的转化率增大
c.生成物的体积百分含量增大 d.容器中的![]() 值变小
值变小
(3)在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如下图所示。T1温度下,将4mol CO2和8 mol H2充入2 L的密闭容器中,10min 后反应达到平衡状态,则0~10min内的平均反应速率v(CH3OCH3)=________________;KA、KB、KC三者之间的大小关系为____________________。
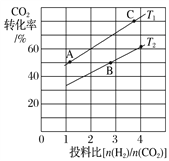
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.25℃,两种酸的电离平衡常数如右表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
(1)0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为____________
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为________________
Ⅱ.某化学小组设计下列实验测定硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液的标定浓度:
步骤1:取20.00mL0.015mol/LK2Cr2O7标准液于250mL锥形瓶中,加入20mL稀硫酸和5mL浓磷酸,用硫酸亚铁铵溶液滴定,接近终点时加入2滴R溶液作指示剂,继续滴定至终点,消耗的体积为10.10mL.
步骤2:重复操作1实验,接近终点时加入4滴R溶液,消耗的体积为10.20mL。
已知:①6Fe2+ +Cr2O72-+14H+=6Fe3+ +2Cr3+ +7H2O,其中Cr3+为绿色
②R溶液的变色原理:R(氧化型,紫红色) ![]() Q(还原性,无色)
Q(还原性,无色)
(3)该实验中需要用到的主要玻璃仪器有锥形瓶、胶头滴管、___________、______________
(4)如何判断滴定达到终点:_______________________________
(5)步骤2的主要作用是________________
(6)硫酸亚铁铵溶液的标定浓度是___________mol/L(保留三位有效数字)
(7)若滴定前锥形瓶中有水,对测定结果的影响是______(填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海藻中提取碘的流程如下图。
![]()
某化学兴趣小组将上述流程②③设计成如图所示:
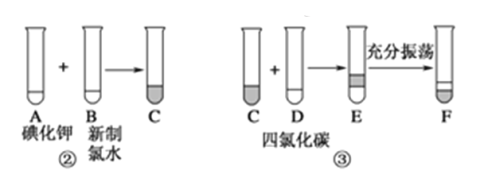
已知②中发生反应的化学方程式为:Cl2+2KI==2KCl+I2。
回答下列问题:
(1)写出提取过程中①③实验操作名称:①________,③________。
(2)F中下层液体的颜色为________色,上层液体中溶质的主要成分为________。从F中得到固态碘还发生反应需进行的操作是______。
(3)用双线桥表示②中的反应电子转移方向和数目:Cl2+2KI==2KCl+I2_______________
(4)提取过程中,消耗标况下Cl256L,碘的提取率为90%,计算能获得碘______g。
查看答案和解析>>
科目: 来源: 题型:
【题目】最近浙江大学成功研制出具有较高能量密度的新型铝一石墨烯(Cn)电池(如图)。该电池分别以铝、石墨烯为电极,放电时电池中导电离子的种类不变。已知能量密度=电池容量(J)÷负极质量(g)。下列分析正确的是
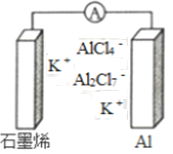
A. 放电时,Cn(石墨烯)为负极
B. 放电时,Al2Cl7-在负极转化为AlCl4-
C. 充电时,阳极反应为4 Al2Cl7-+3e-=A1+7AlCl4-
D. 以轻金属为负极有利于提高电池的能量密度
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)已知氢气在氧气中燃烧生成3.6g液态水放热57.16kJ的热量,请写出表示氢气燃烧热的热化学方程式___________________________;若断开H2(g)中1molH-H需要吸收436kJ的能量,生成H2O(g)中的1mol H-O键放出463 kJ的能量,18g液态水转化为水蒸气需要吸收44 kJ的能量,则断开1molO2中的共价键需要吸收___________kJ的能量。
(2)氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的正极反应式:___
(3)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______
(4)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________
a.容器内气体压强保持不变
b. 1 mol MHx能够吸收ymol H2
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则c(H2)增大
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①请写出阳极电极反应式________________________
②电解过程中,须将阴极产生的气体及时排出,其原因是______________________
③c( Na2FeO4)随初始c(NaOH)的变化如图2,请分析在实验中控制NaOH浓度为14mol/L的原因:______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说有关说法正确的是
A. 在常温常压下,11.2L N2含有的分子数小于0.5NA
B. 标准状况下,2.24L SO3含有的原子数为0.4NA
C. 将1L 2mol/L的FeCl3溶液,其中含有Cl-为2NA
D. 46g NO2和N2O4混合气体所含氧原子数目有可能为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. FeCl3溶液可用于铜质印刷线路板的制作,该反应是置换反应
B. 用惰性电极电解含有H218O的普通水时,阳极可能产生两种相对分子质量不同的氧分子
C. 反应A(g) ![]() B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
D. 3x%的A物质的溶液与x%的A物质的溶液等体积混合后,溶液的质量分数小于2x%,则A物质可能为乙醇
查看答案和解析>>
科目: 来源: 题型:
【题目】工业生产需要大量原料,消耗大量能源,在得到所需产品同时产生了大量废气、废水、废渣。某工厂排放的废水中含有Cu2+、Fe2+、Hg2+、H+等离子,某化学小组为了充分利用资源和保护环境,准备回收废水中的铜和汞,同时得到绿矾。他们设计了如下实验方案:
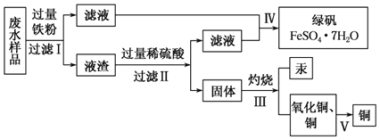
(1)步骤Ⅰ中加入过量铁粉的目的是_______________________________。
(2)步骤Ⅱ中________(填“能”或“不能”),用盐酸代替硫酸,写出步骤Ⅱ中涉及反应的化学方程式:____________________________________。
(3)步骤Ⅳ得到绿矾的操作蒸发浓缩______________、______________、洗涤、干燥。现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等,完成步骤Ⅳ的实验操作还需要选择的玻璃仪器是___________。
(4)步骤 V利用氧化铜制取铜有如下四种方案:
方案甲:利用氢气还原氧化铜;方案乙:利用一氧化碳还原氧化铜;
方案丙:利用炭粉还原氧化铜;
方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉、过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。从安全角度考虑,方案_________不好;从产品纯度考虑,方案_________不好。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.NaNO2 因外观和食盐相似,又有咸味,容易使人误食中毒。已知 NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是_____。
(2)根据上述反应,鉴别 NaNO2 和 NaCl。可选用的物质有①水、②碘化钾淀粉试纸③淀粉、④白酒、⑤食醋,你认为必须选用的物质有_____(填序号)。
(3)请配平以下化学方程式:______
![]() Al+
Al+![]() NaNO3+
NaNO3+![]() NaOH=
NaOH=![]() NaAlO2+
NaAlO2+![]() N2↑+
N2↑+![]() H2O
H2O
若反应过程中转移 5 mol 电子,则生成标准状况下 N2 的体积为_____L。
Ⅱ.“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成 VO2+。
(4)请写出金属钒与浓硝酸反应的离子方程式:_____。
(5)V2O5 是两性氧化物,与强碱反应生成钒酸盐(阴离子为 VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出 V2O5 分别与烧碱溶液和稀硫酸反应生成的盐的化学式:_____、_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com