
科目: 来源: 题型:
【题目】下列各组物质中,物质之间通过一步反应就能实现图示变化的是
物质编号 | 物质转化关系 | a | b | c | d |
① |
| NO | NO2 | N2 | HNO3 |
② | Na2O | Na2O2 | Na | NaOH | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A. ①②③ B. ③④
C. ①③④ D. ②④
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CO32-、Cl-、OH-、SO42- |
已知:
①常温下A、C溶液pH均大于7,B溶液pH小于7,D溶液pH等于7;
②C溶液和D溶液混合只产生白色沉淀;
③B溶液和C溶液混合共热时只产生刺激性气味的气体;
④A溶液和D溶液混合时无明显现象。
请回答:
(1)D的化学式_______________________。
(2)实验③反应的离子方程式_______________________。
(3)从B、C、D中选取物质,设计实验方案确定A的组成_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知固体Na2SO3受热易分解,实验流程和结果如下:
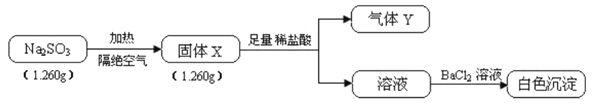
气体Y是一种纯净物,在标准状况下的密度为1.518g·L-1、请回答:
(1)气体Y分子的电子式___,白色沉淀的化学式_______。
(2)该流程中的Na2SO3受热分解的化学方程式__________。
(3)另取固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,写出产生淡黄色沉淀的离子方程式____________(不考虑空气的影响)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验现象描述正确的是
选项 | 实验 | 现象 |
A | 向饱和Na2CO3溶液中通入足量的CO2气体 | 无明显现象 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝滴落下来 |
C | 向Al2(SO4)3溶液中滴加过量NaOH溶液 | 产生大量白色沉淀 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】锌铝合金是以Zn、Al 为主,Cu、Mg为辅的多元化合金。测定其中Cu含量的实验步骤如下:
①称取该合金样品1.100 g,用稀H2SO4和H2O2溶解后煮沸除去过量H2O2,残液定容于250mL容量瓶中;
②用移液管移取50.00mL配制液于250mL碘量瓶中,调节溶液的pH=3~4,加入过量KI溶液2Cu2++4I-=2CuI↓+I2)和3-4滴淀粉溶液;
③用1.100x10-2mol/LNa2S2O3溶液滴定生成的I2至终点(I2+2S2O32-=2I-+S4O62-),消耗Na2S2O3溶液6.45mL。
请回答:
(1)步骤①中溶解Cu的离子方程式___________________。
(2)步骤③中判断滴定终点的方法_______________________。
(3)合金中Cu的质量分数_____________。(结果保留三位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】某离子化合物M(仅含三种元素)是一种镁基储氢材料。为探究M的组成和性质,设计并完成如下实验:
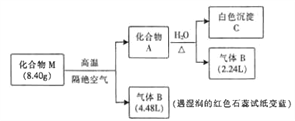
已知:气体的体积均在标准状况下测定,化合物A仅含两种元素。
请回答:
(1)化合物M中阳离子和阴离子的个数比为1:2,则M的化学式为_______________。
(2)化合物A 与H2O反应的化学方程式_______________。
(3)镁条在足量的气体B中燃烧可生成化合物M 和气体D,则D的分子式为_______________。
(4)研究表明液态B也是一种良好的储氢物质,其储氢容量可达17.6%,已知液态B中存在类似水的电离(2H2O![]() H3O++OH-),用Pt电极对液态B进行电解可产生两种气态单质。
H3O++OH-),用Pt电极对液态B进行电解可产生两种气态单质。
①液态B的电离方程式________________。
②电解时,阴极的电极反应式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学将反应2Fe3++2I-=2Fe2++I2设计成下图所示的原电池:

实验步骤及现象如下:
①闭合开关,指针发生偏转,随后电流计读数逐渐变小,当读数变为零时,打开开关;
②取少许甲烧杯中溶液,滴入3~4滴淀粉溶液,溶液显蓝色;
③取少许乙烧杯中溶液,滴入3~4滴KSCN溶液,溶液显血红色;
④向乙烧杯中加入少量FeCl2固体,再次闭合开关,指针向左偏转(最后读数变为零)。
【查阅资料】灵敏电流计指针总是偏向电源正极;原电池中存在内阻,会影响反应进程。
请回答:
(1)步骤①中,开始时指针向_____(填“左"或“右”)偏转,甲烧杯中发生的电极反应式____________________。
(2)经步骤①后,乙烧杯溶液中新增金属阳离子____________(填离子符号)。
(3)步骤④中指针向左偏转,乙烧杯中发生的电极反应式______________________。
(4)要证明2Fe3++2I-![]() 2Fe2++I2 为可逆反应,你认为上述实验步骤不必做的是______________(填序号)。
2Fe2++I2 为可逆反应,你认为上述实验步骤不必做的是______________(填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】取7.90gKMnO4,加热分解后剩余固体7.42g。该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A,产物中锰元素以Mn2+存在。
请计算:
(1)KMnO4的分解率_______________。
(2)气体A的物质的量_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:
C10H18(l)![]() C10H12(l)+3H2(g) △H1
C10H12(l)+3H2(g) △H1
C10H12(l)![]() C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
△H1>△H2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,十氢萘的常压沸点为192℃;在192℃,液态十氢萘的脱氢反应的平衡转化率约为9%。请回答:
(1)有利于提高上述反应平衡转化率的条件是_________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)研究表明,将适量的十萘奈置于恒容密闭反应器中,升高温度带来高压,该条件下也可显著释氢,理由是______________________________________________________。
(3)温度335℃,在恒容密闭反应器中进行高压液态十氢萘(1.00 mol)催化脱氢实验,测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间变化关系,如图1所示。
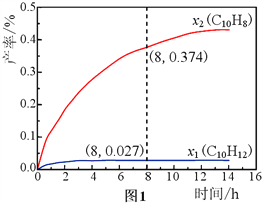

①在8 h时,反应体系内氢气的量为__________mol(忽略其他副反应)。
②x1显著低于x2的原因是________________________________________。
③在图2中绘制“C10H18→C10H12→C10H8”的“能量~反应过程”示意图。
Ⅱ.科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。
(4)电极反应式:________________________________和2Fe+3H2O+N2=Fe2O3+2NH3。
查看答案和解析>>
科目: 来源: 题型:
【题目】用1L 0.1mol·L-1NaOH溶液吸收0.07molCO2,所得溶液中n(Na2CO3)和n(NaHCO3)之比约为
A. 3︰4 B. 3︰1 C. 2︰3 D. 3︰2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com