
科目: 来源: 题型:
【题目】(1)现有下图所示A、B、C、D四种仪器,写出名称:
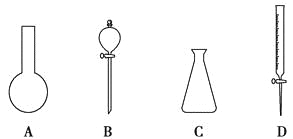
A. ,B. ,
C. ,D. 。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,可使仪器不漏液或不漏气。在下列仪器中:①试管;②分液漏斗;③细口试剂瓶;④广口试剂瓶;⑤集气瓶;⑥滴瓶;⑦酸式滴定管;⑧碱式滴定管,肯定用不到“磨砂”处理的有 (填序号)。
(3)以下是中学化学实验中常见的定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平
①其中标有仪器使用温度的是 (填编号)。
②实验时用来精确量取液体体积的是 (填编号)。
③使用前要检查仪器是否漏液的是 (填编号)。
(4)玻璃棒的作用主要有以下四种:①搅拌、②引流、③蘸取溶液、④转移固体。不同实验中其作用可能不完全相同,请回答下列问题:
A.在“用无水碳酸钠配制100 mL 0.12 mol·L-1的碳酸钠溶液”的实验中,玻璃棒的作用是 (填写编号)。
B.在“用氢氧化钠溶液、碳酸钠溶液、氯化钡溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以制得纯净的食盐”的实验中玻璃棒的作用可能是 (填写编号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某种混合气体可能有N2、HCl、CO,把混合气体依次通过足量的NaHCO3溶液和灼热的氧化铜粉末,气体体积都没有变化;再通过足量的过氧化钠固体,气体体积减小;最后经过铜网,经充分反应后气体体积又减少,但还有气体剩余。以下对混合气体组成的判断,正确的是( )
A. 一定没有N2,HCl和CO中至少有一种
B. 一定有N2、HCl和CO
C. 一定有N2,HCl和CO中至少有一种
D. 一定有N2和HCl,没有CO
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Cu2+ Na+ |
阴离子 | NO3- SO42- Cl- |
下图1所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了32g。常温下各烧杯中溶液的pH与电解时间(t)的关系如图2所示。据此回答下列问题:

(1)M为电源的__________极(填“正”或“负”);
(2)写出甲烧杯中反应的化学方程式____________________;
(3)计算电极f上生成的气体在标准状况下的体积_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知:C(s)+2H2(g)![]() CH4 △H=-73kJ/mol
CH4 △H=-73kJ/mol
2CO(g)![]() C(s)+CO2(g) △H=-171kJ/mol
C(s)+CO2(g) △H=-171kJ/mol
CO(g)+3H(g)![]() CH4(g)+H2O(g) △H=-203kJ/mol。
CH4(g)+H2O(g) △H=-203kJ/mol。
写出CO与H2O(g)反应生成H2和CO2的热化学方程式_________________。
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,已知T℃k(NH3·H2O)=1.74×10-5;k1(H2S)=1.07×10-7,k2(H2S)=1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是_______。
A.c(NH4+)>c(HS-)>c(OH-)>c(H+) B.c(HS-)>c(NH4+)>(S2-)>c(H+)
C.c(NH4+)>c(HS-)>c(H2S)>c(H+) D.c(HS-)>c(S2-)>c(H+)>c(OH-)
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
①一定温度时,在一个体积为2L的恒容密闭容器中,加入lnmolCH4和1.4mol水蒸气发生上述反应,5min后达平衡,生成0.2molCO,用H2表示该反应的速率为_________。此反应的平衡常数为_____(结果保留到小数点后三位)。
②下列说法中能说明此反应达到平衡状态的是_________。
A.体系的压强不再发生变化
B.生成1molCH4的同时消耗3molH2
C.各组分的物质的量浓度不再改变
D.体系的密度不再发生变化
E.反应速率V(CH4):V(H2O)v(CO):v(H2)=1:1:1:3
(4)甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)==CO2(g)+3H2(g) △H=+49kJ/mol。某温度下,将[n(H2O):n(CH3OH)]=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为______。
(5)如图所示,直接甲醇燃料电池是质子交换膜燃料电池的一种变种,它直接使用甲醇而勿需预先重整。请写出电池工作时的负极反应式:__________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】373K时,某 1L密闭容器中加入2mol NH3发生如下可逆反应:2NH3(g)![]() N2(g)+3H2(g)。其中物质H2的物质的量变化如下图所示。
N2(g)+3H2(g)。其中物质H2的物质的量变化如下图所示。
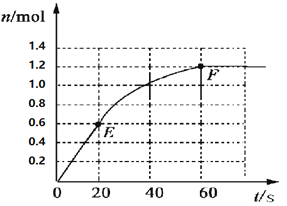
(1)前20 s内NH3(g)的平均反应速率为___________;
(2)373K时该反应的平衡常数的值为______________;
(3)若在此平衡体系中再加入1mol的NH3,与原平衡比较,新平衡时NH3的转化率______(填“增大”或“减小”,下同),NH3的平衡浓度_________。
(4)将原平衡升温至473K,重新达平衡时(其他条件不变),H2的平衡浓度为NH3的2倍,该反应的正反应为_________(填“放热反应”或“吸热反应”),为增大平衡体系中H2的物质的量,下列措施正确的是(其它条件相同)______。
a.升高温度 b.扩大容器的体积 c.加入合适的催化剂 d.再充入N2
查看答案和解析>>
科目: 来源: 题型:
【题目】将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸的体积有如图所示的关系(不考虑CO2在水中的溶解)。下列说法不正确的是( )
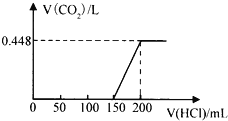
A. 滴加盐酸0→150mL段发生的反应依次为OH-+H+=H2O、CO32-+H+=HCO3-
B. 所用盐酸的物质的量浓度为0.4 molL﹣1
C. CO2体积不再改变时,溶液中的溶质为NaCl
D. 该样品中NaOH与Na2CO3物质的量之比为1:2
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列六种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④Al2(SO4)3 ⑤CH3COOH ⑥NaHCO3
(1)25℃时,0.1mol·L-1①溶液呈______性,0.1mol·L-1②溶液的pH________7(填“>”、“=”或“<”);其原因是______________________________________(用离子方程式表示);
(2)常温(填“>”、“=”或“<”)下,浓度均为0.1mol/L的③和⑥的溶液中离子种类________(填“相同”或是“不相同”),溶液的pH:③_________⑥(填“>”、“=”或“<”);
(3)将④溶液加热蒸干并灼烧最终得到的物质是____________(填化学式);
(4)常温下0.1 mol/L的⑤溶液加水稀释过程中,下列表达式的数据一定变大的是_________。
A.c(H+) B.  C.c(H+)·c(OH-)
C.c(H+)·c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)(CH3)2CHCH(CH3)2的系统命名为___________________;
(2)有机物的结构可用“键线式”简化表示,CH3-CH=CH-CH3的键线式为________;
(3)下列化合物分子中,在核磁共振氢谱图中能给出一种信号的是(______)
A.CH3CH2CH3 B. CH3COCH2CH3 C.CH3CH2OH D.CH3OCH3
(4)分子式为C2H6O的有机物,有两种同分异构体,乙醇(CH3CH2OH)、甲醚(CH3OCH3),则通过下列方法,不可能将二者区别开来的是 (______)
A.红外光谱 B. 1H核磁共振谱 C.质谱法 D.与钠反应
(5)已知乙烯分子是平面结构, 1,2-二氯乙烯可形成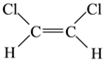 和
和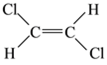 两种不同的空间异构体,称为顺反异构。下列能形成类似上述空间异构体的是(_____)
两种不同的空间异构体,称为顺反异构。下列能形成类似上述空间异构体的是(_____)
A.1-丙烯 B.4-辛烯 C.1-丁烯 D.2-甲基-1-丙烯
查看答案和解析>>
科目: 来源: 题型:
【题目】如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是

A. X极是电源负极,Y极是电源正极
B. 电解过程中CuSO4溶液的pH逐渐增大
C. a极的电极反应是2Cl--2e-=Cl2↑
D. Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验:
①向Fe2(SO4)3和CuSO4的混合液中加入过量铁粉,充分反应,有红色固体析出,过滤。
②取①中滤液,向其中滴加KSCN溶液,观察现象。
判断下列说法正确的是
A. 氧化性Cu2+>Fe3+
B. ①中所得固体只含铜
C. ①中滤液含有Cu2+和Fe2+
D. ②中不会观察到溶液变红
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com