
科目: 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,有关说法正确的是
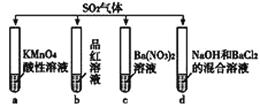
A. 试管a中实验可以证明SO2具有漂白性
B. 试管b中溶液褪色,说明SO2具有强氧化性
C. 试管c中能产生白色沉淀,该沉淀的成分为BaSO3
D. 试管d中能产生白色沉淀,该沉淀完全溶于稀盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 在标准状况下,11.2 L NO与11.2 L O2混合后所含原子数为NA
B. 110 g Na2S2中含有的离子数为3NA
C. 0.1 mol·L-1 Na2CO3溶液1 L所含碳酸根数目为0.1NA
D. 1 mol Cl2与足量的水反应时断裂的Cl-Cl键为NA个
查看答案和解析>>
科目: 来源: 题型:
【题目】取一定质量NaHCO3和Na2O的固体混合物溶于适量的水,将所得溶液分成两等份,向其中一份水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生的气体体积与所加盐酸体积之间的关系如图所示;向另一份水溶液中加入过量Ba(OH)2溶液,得到白色沉淀39.4g。试回答下列问题:

(1)盐酸的物质的量浓度为___________;
(2)固体混合物中NaHCO3与Na2O物质的量之比_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知亚硫酸钠在空气中能被氧气氧化成硫酸钠。某兴趣小组为检验亚硫酸钠固体是否变质及探究二氧化硫的性质,设计了如下实验:

I.检验Na2SO3是否变质
(1)往圆底烧瓶A中加入待测液1.0 mol/LNa2SO3溶液50mL溶液a为_______,溶液b为_______。
(2)向装置A中滴加足量溶液a,Na2SO3反应完全后,微热装置A使SO2完全逸出。实验前后测得C装置增重2.4g,则Na2SO3溶液物质的量浓度为_______mol/L,并判断Na2SO3固体是否变质______(填是或否)。

II.利用以上装置制备适量SO2,设计实验比较H2SO3、 H2CO3和H2SiO3的酸性强弱,并探究SO2的化学性质。
(1)试剂X是___________;试剂Y是___________;试剂Z是___________。
(2)关闭止水夹b,打开止水夹a,向装置中通入SO2,当观察到_________,即证明H2CO3酸性比H2SiO3强。
(3)关闭止水夹a,打开止水夹b,继续通入SO2,溴水褪色,说明SO2具有_______;写出相应的离子方程式______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用硫铁矿(FeS2)焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:
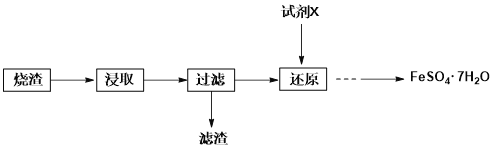
(1)试剂X可能为______________。
A.双氧水 B.酸性高锰酸钾 C.浓硫酸 D.SO2
(2)从还原后溶液中得到产品,应进行的操作是___________、____________、过滤、洗涤、干燥。
(3)七水合硫酸亚铁(FeSO4·7H2O)在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤a:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成500 mL溶液;
步骤b:取上述溶液25mL于锥形瓶中,逐渐滴加0.0500 mol/L的酸性KMnO4溶液,至恰好完全反应,记录消耗的酸性KMnO4溶液的体积(假定药品中其他成分不与酸性KMnO4反应);
步骤c:重复步骤b2~3次,平均消耗酸性KMnO4溶液20.00mL。
已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,则该补血剂中亚铁离子的含量为_____mg/片。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铜晶体(CuSO4·xH2O)是一种用途广泛的试剂。某小组拟探究硫酸铜性质并测定其晶体中结晶水含量。
实验(一):探究硫酸铜的氧化性。
取适量硫酸铜溶液于试管,加入(NH4)2SO3溶液,产生沉淀M。过滤、洗涤、得M固体。为了探究M的组成,进行如下实验:
①取一定量M固体分成两份;
②在一份固体中加入稀硫酸,产生刺激性气味的气体X,将气体X通入溴水中,溴水褪色;溶液变成蓝色并有红色固体生成。
③在另一份固体中加入浓烧碱溶液,共热,产生的气体Y通入甲基橙溶液中,溶液变黄色。
(1)X的化学式是______________。
(2)经测定,M中阳离子、阴离子个数之比为2∶1。写出M与稀硫酸反应的化学方程式:____________。
实验(二):探究硫酸铜晶体的热稳定性。
他们取少量硫酸铜晶体进行实验,装置如图所示。
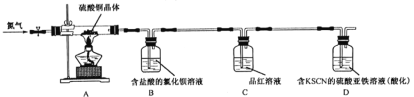
观察到的实验现象:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中产生白色沉淀;D中无色溶液变红色溶液。
(3)B中用盐酸酸化的目的是______________;C中现象是__________________________________。
(4)D中有单质参加反应的离子方程式:________________________________________________。
实验(三):测定硫酸铜晶体中结晶水含量。
取wg硫酸铜晶体(CuSO4·xH2O)配制成250mL溶液,取20.00mL所配制溶液用cmol·L-1EDTA(简化为Na4Y)溶液滴定至终点,消耗EDTA滴定液休积为VmL。(滴定反应:Cu2++Y4-=CuY2-)
(5)x=_____________________(用代数式表示)。
(6)下列情况会使测得x值偏大的是______________(填字母)。
a.样品失去部分结晶水 b.滴定管未用EDTA溶液润洗
c.开始读数时滴定管尖嘴有气泡(终点时尖嘴无气泡) d.滴定终点时俯视刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜矿(主要成分CuFeS2)是提取Cu的主要原料。
已知:2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(Ⅰ)
Cu2S+3SO2+2FeO(Ⅰ)
产物Cu2S在1200 ℃高温下继续反应:2Cu2S+3O2==2Cu2O+2SO2 (Ⅱ)
2Cu2O+Cu2S==6Cu +SO2↑ (Ⅲ)
假定各步反应都完全。则下列说法正确的是
A. 反应Ⅰ中CuFeS2仅作还原剂
B. 取12.5g黄铜矿样品,经测定含3.60g硫,则矿样中CuFeS2质量分数一定为82.8%
C. 由6molCuFeS2生成6molCu消耗O2的物质的量为14.25mol
D. 6molCuFeS2和15.75molO2反应,理论上可得到铜的物质的量为3mol
查看答案和解析>>
科目: 来源: 题型:
【题目】某香料I的一种合成路线如下:

回答下列问题:
(1)C的名称为______________;H所含官能团名称是______________。
(2)B→C的反应类型是______________;写出I的结构简式:______________。
(3)G分子最多有______________个原子共平面。
(4)写出A→B的化学方程式:____________________________。
(5)J是I的同分异构体,同时满足下列条件的J的结构有_______种。其中,一种核磁共振氢谱有6个峰且峰的面积之比为1∶1∶1∶2∶2∶3的结构简式为______________。
①能使溴的四氯化碳溶液褪色
②能与碳酸氢钠溶液反应产生CO2
③属于芳香族化合物,且苯环上的一氯代物只有2种
(6)参照上述流程,以乙烯和OHC-CHO为原料合成HOOCCH=CHCOOH,设计合成路线:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式磷酸钙[Ca10(PO4)6(OH)2],工业上叫羟基磷灰石或羟磷灰石,是人的牙齿中比较坚硬的物质,在水中有微弱的溶解,这是牙齿损坏的主要原因。氟磷酸钙也称氟磷灰石,它的化学式为Ca10(PO4)6F2,是牙表面牙釉的主要成分。
回答下列问题:
(1)基态钙原子的价层电子排布式为____________。基态磷原子的未成对电子数为______________。
(2)碱式磷酸钙中含氧酸根离子的中心原子杂化类型是______________________,含氧酸根离子的空间构型为______________;
(3)氢氟酸溶液中存在:2HF![]() H2F2,H2F2为一元酸,则氢氟酸溶液中含氟阴离子是______________(填离子符号)。氢氟酸中存在H2F2的原因是______________________________________________。与H2F+互为等电子体的分子是________________(写出一个即可)。
H2F2,H2F2为一元酸,则氢氟酸溶液中含氟阴离子是______________(填离子符号)。氢氟酸中存在H2F2的原因是______________________________________________。与H2F+互为等电子体的分子是________________(写出一个即可)。
(4)O、F、P的电负性由小到大的顺序为______________。
(5)NH3和PH3的构型相似,NH3的键角略大于PH3,从原子结构角度解释其原因:________________。
(6)CaF2晶胞如图所示。位于体内的粒子的配位数为______________。

已知:氟化钙晶体密度为ρg·cm-3,NA代表阿伏加德罗常数的值。
氟化钙晶体中Ca2+和F-之间最近核间距(d)为______________pm(只要求列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组为探究不溶性固体X的组成和性质,进行了如下实验。已知X是一种仅含有四种元素的具有固定成的盐类物质,H由碘元素和另外一种元素组成,图中所有气体体积均在标准状况下测定。
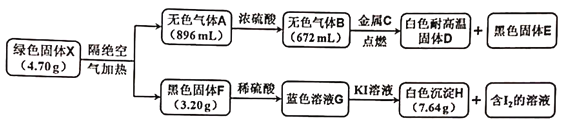
请回答下列问题:
(1)写出X的化学式__________;
(2)写出C的原子结构示意图___________;组成E元素的某种核素常用于考古断代,该原子核内中子数为8,写出该校素的原子符号___________。
(3)C在装有B的集气瓶中燃烧,其实验现象为___________;并写出相应的化学方程式___________。
(4)已知H能与含NaClO的碱性溶液反应生成NaIO3和蓝色絮状沉淀,试写出该反应的离子方程式____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com