
科目: 来源: 题型:
【题目】PEI [ ]是一种非结晶性塑料。其合成路线如下(某些反应条件和试剂已略去):
]是一种非结晶性塑料。其合成路线如下(某些反应条件和试剂已略去):

已知:
(1)A为链状烃。A的化学名称为______。
(2)A→B的反应类型为______。
(3)下列关于D的说法中正确的是______(填字母)。
a.不存在碳碳双键
b.可作聚合物的单体
c.常温下能与水混溶
(4)F由4-氯-1,2-二甲苯催化氧化制得。F所含官能团有-Cl和______。
(5)C的核磁共振氢谱中,只有一个吸收峰。仅以2-溴丙烷为有机原料,选用必要的无机试剂也能合成C写出有关化学方程式:______。
(6)F→K 的反应过程中有多种副产物。其中一种含有3个环的有机物的结构简式是___。
(7)以E和K为原料合成PEI分为三步反应。

写出中间产物1、中间产物2的结构简式:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:

(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的化学方程式_____________。
(2)D中放入浓H2SO4,其目的是_____________________________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是___________,对比E和F中现象的差异可得出的结论及解释是________________________________。
(4)G处的现象是____________________________________。
(5)画出H处尾气吸收装置图并注明试剂____________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式__________。
②需“密闭保存”的原因____________________________________________。
(7)现在有一种名为“净水丸”的产品也能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。亚硫酸钠将水中多余次氯酸除去的离子反应方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。通过对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
(1)反应2NO2(g) ![]() N2(g)+2O2(g),设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。
N2(g)+2O2(g),设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。

则A点时,NO2的转化率为_______________,B点时,设容器的总压为a Pa,则平衡常数Kp为____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g)。
CH3OH(g) +H2O(g)。
①该反应ΔH_______0(填“>”、“<”或“=”)
②下列叙述能说明此反应达到平衡状态的是____________。(填字母)
a.混合气体的平均相对分子质量保持不变
b.1 mol CO2生成的同时有3 mol H—H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
③ 反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
反应时间 | CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
反应Ⅰ:恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应Ⅱ:绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
反应Ⅰ,前10min内的平均反应速率v(CH3OH)=_______________________________。达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)____________K(II)(填“>”、“<”或“=”);平衡时CH3OH的浓度c(I)____________c(II)(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列数据:
物 质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙 醇 | -114 | 78.4 | 0.79 |
乙 酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.900 |
浓H2SO4 | 338 | 1.84 |



实验室制取乙酸乙酯的主要装置如上图I所示,主要步骤为:①在30mL的大试管中按体积比2:3:2的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到盛有10mL饱和Na2CO3溶液的(加入2滴酚酞试液)试管中;③小火加热试管中的混合液;④待小试管中收集约2mL产物时停止加热,撤出小试管并用力振荡,然后静置;⑤分离出纯净的乙酸乙酯。请回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是_____________________________;
(2)写出该实验制取乙酸乙酯的化学方程式_________________________________,浓H2SO4的作用是 _______________________;
(3)步骤③中,用小火加热试管中的混合液,其原因_________________________;
(4)步骤④所观察到的现象是___________________________________________________
(5)步骤⑤中,分离出乙酸乙酯的方法是_________________________________;
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取圆底烧瓶中产物)。你认为哪种装置更合理,为什么?_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某醛的结构简式为(CH3)2C===CHCH2CH2CHO,通过实验方法检验其中的官能团。
(1)实验操作中,应先检验哪种官能团?________,原因是______________________。
(2)检验分子中醛基的方法是_____________________________________________,化学方程式为____________________________________________________________。
(3)检验分子中碳碳双键的方法是__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】由碳、氢、氧3种元素组成的有机物A,相对分子质量为152,其分子中C、H原子个数比为1∶1,氧元素的质量分数为31.58%。A遇FeCl3溶液显紫色,A能与NaHCO3溶液反应,其苯环上的一氯取代物有两种,请回答下列问题:
(1)A的分子式是_______________________________。
(2)A的结构简式为________________________________________。
(3)A可以发生如图所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式________。

(4)甲、乙两装置均可用作实验室由C制取B的装置,乙图采用甘油浴加热(甘油沸点290 ℃,熔点18.17 ℃),当甘油温度达到反应温度时,将盛有C和浓硫酸混合液的烧瓶放入甘油中,很快达到反应温度。甲、乙两装置相比较,乙装置有哪些优点________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是_________。
(2)25℃时,利用pH试纸测得0.1molL-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将_____(填“增大”、“减小”或“无法确定”)。
(3)电化学法是合成氨的一种新方法,其原理如图所示,阴极的电极反应式是_____。

(4)废水中含氮化合物的处理方法有多种。
① NaClO溶液可将废水中的NH4+转化为N2。若处理过程中产生N2 0.672 L(标准状况),则需要消耗0.3 mol·L-1的NaClO溶液______________L。
②在微生物的作用下,NH4+经过两步反应会转化为NO3-,两步反应的能量变化如图所示。则1 mol NH4+(aq)全部被氧化成NO3-(aq)时放出的热量是______________kJ。
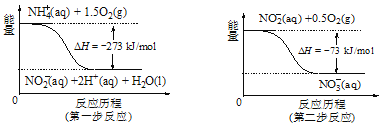
③ 用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH______(填“升高”、“降低”或“不变”)。
(5)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。若某次捕捉后得到pH=10 的溶液,则溶液c(CO32-)∶c(HCO3-)=_______。 [常温下K1(H2CO3)=4.4×10-7、 K2(H2CO3)=5×10-11]。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列变化过程中,⊿S<0的是: ( )
A.干冰的升华B.NH3 (g) +HCl (g) =NH4Cl (s)
C.氯化钠溶于水中D.CaCO3 (s) 分解为CaO (s) 和CO2(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验现象、解释和结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 |
B | 淀粉水解后的溶液加入新制Cu(OH)2浊液,再加热 | 无砖红色沉淀 | 淀粉水解产物不含醛基 |
C | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
D | 向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1 mol/L的NaI溶液,再振荡, | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com