
科目: 来源: 题型:
【题目】下列变化中,气体被还原的是
A.CO2使Na2O2固体变白B.Cl2使KBr溶液变黄
C.一定条件下H2能使CuO固体变红D.NH3使AlCl3溶液产生白色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2通入BaCl2溶液中并不产生沉淀,在下图右侧的Y形管中放置合适的药品,进行合理操作,在BaCl2溶液中可以看到白色沉淀.右侧Y形管中放的药品是( )

A. Cu和浓硝酸 B. CaO和浓氮水
C. Na2SO3和较浓硫酸 D. KMnO4溶液和浓盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关。下列说法正确的是
A.医用消毒酒精中乙醇的浓度(体积分数)为95%
B.硅胶可用作瓶装药品、袋装食品的干燥剂
C.化石燃料完全燃烧不会造成大气污染
D.铁比铜金属性强,FeCl3腐蚀Cu刻制印刷电路板
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Fe3+、CO32-、SO42-、NO3-中的几种,且各种离子浓度相等。加入铝片,产生H2。下列说法正确的是
A. 向原溶液中加入Cu片发生:3Cu+8H++2NO3-=3Cu2++4H20+2NO↑
B. 向原溶液中加入过量氨水发生:Fe3++H++4NH3·H2O=Fe(OH)3↓+4NH4+
C. 向原溶液中加入过量Ba(OH)2溶液发生:Ba2++20H-+SO42-+NH4++H+=NH3·H2O +BaSO4↓+H2O
D. 向原溶液中加入BaCl2溶液发生:2Ba2++CO32-+SO42-=BaCO3↓+BaSO4↓
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A.将废铅蓄电池的铅泥和废硫酸作深埋处理
B.钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀的作用
C.生铁中含有碳,抗腐蚀能力比纯铁弱
D.积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用
查看答案和解析>>
科目: 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3的混合物中加入100mL浓度为1.0mol·L-1的盐酸,恰好使混合物完全溶解,有气体放出,所得溶液中加入KSCN溶液后无红色出现。若用足量的CO在高温下还原相同质量此混合物,能得到铁的质量是( )
A. 11.2g B. 5.6g
C. 2.8g D. 1.4g
查看答案和解析>>
科目: 来源: 题型:
【题目】工业废水中常含有一定量氧化性较强的Cr2O72-,利用滴定原理测定Cr2O72-含量方法如下:
步骤Ⅰ:量取30.00 mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液充分反应:Cr2O72-+6I-+14H+ === 2Cr3++3I2+7H2O。
步骤Ⅲ:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000 molL-1Na2S2O3溶液进行滴定,数据记录如下:(I2+2Na2S2O3 === 2NaI+Na2S4O6)
滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
笫一次 | 1.02 | 19.03 |
第二次 | 2.00 | 19.99 |
第三次 | 0. 20 | a |
(1)步骤Ⅰ量取30.00 mL废水选择的仪器是_____。
(2)步骤Ⅲ中滴加的指示剂为_____。滴定达到终点的实验现象是____。
(3)步骤Ⅲ中a 的读数如图所示,则:
① a=_____。
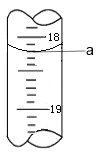
② Cr2O72-的含量为____gL-1。
(4)以下操作会造成废水中Cr2O72-含量测定值偏高的是_____。
A. 滴定终点读数时,俯视滴定管的刻度
B. 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D. 量取Na2S2O3溶液的滴定管用蒸馏水洗后未用标准液润洗
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸乙烯(CH3COOCH=CH2)是一种重要的有机化工原料,以二甲醚(CH3OCH3)与合成气(CO、H2)为原料,醋酸锂、碘甲烷等为催化剂,在高压反应釜中一步合成醋酸乙烯及醋酸。
回答下列问题:
(1)常温下,将浓度均为a mol/L的醋酸锂溶液和醋酸溶液等体积混合,测得混合液的pH=b,则混合液中c(CH3COO-)=______mol/L( 列出计算式即可)。
(2)合成二甲醚:
Ⅰ.2H2(g)+CO(g)=CH3OH(g) ΔH1=-91.8kJ/mol;
Ⅱ.2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ/mol;
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.3 kJ/mol.
已知:H-H 的键能为436kJ/mol,C=O的键能为803kJ/mol,H-O的键能为464kJ/mol,则C≡O的键能为_____kJ/mol.
(3)二甲醚(DME)与合成气一步法合成醋酸乙烯(VAC)的反应方程式为2CH3OCH3(g)+4CO(g)+H2(g) ![]() CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
①0~10min内,用CO浓度变化表示的平均反应速率v(CO)=______;该温度下,该反应的平衡常数K=__________。
②下列能说明该反应达到平衡状态的是______(填选项字母)。
A.V正(DME)=v逆(H2)≠0
B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化
D.c(CO):c(VAC)=4:1
③如图是反应温度对二甲醚(DME)的转化率和醋酸乙烯(VAC)选择性(醋酸乙烯的选择性Svac=![]() )的影响,该反应的ΔH______0(填“>”“<”或“=”);控制的最佳温度是___________.
)的影响,该反应的ΔH______0(填“>”“<”或“=”);控制的最佳温度是___________.

④保持温度不变,向反应釜中通入氩气增大压强,则化学平衡______(填“向正反应方向”“向逆反应方向"或“不”)移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】消除氮氧化物(主要为NO和NO2)污染是“蓝天计划”的重要内容之一。
(1)甲烷还原方法是在催化剂作用下可消除氮氧化物(主要为NO和NO2)污染, NO、O2和CH4的混合物反应体系主要发生如下反应:
2NO(g) + O2(g)![]() 2NO2(g) ΔH=-113.0 kJmol-1 ①
2NO2(g) ΔH=-113.0 kJmol-1 ①
CH4(g) + 2O2(g)![]() CO2(g) +2H2O (g) ΔH=-802. 3 kJmol-1 ②
CO2(g) +2H2O (g) ΔH=-802. 3 kJmol-1 ②
CH4(g) + 4NO(g)![]() 2N2(g) + CO2(g) + 2H2O (g) ΔH=-1160kJmol-1 ③
2N2(g) + CO2(g) + 2H2O (g) ΔH=-1160kJmol-1 ③
① 则反应CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O (g)的ΔH= ______。
N2(g)+CO2(g)+2H2O (g)的ΔH= ______。
② 反应CH4(g) + 2O2(g)![]() CO2(g) +2H2O (l) ΔH=-a kJmol-1,则a ____ 802. 3(填“>”、“<”或“=”)。
CO2(g) +2H2O (l) ΔH=-a kJmol-1,则a ____ 802. 3(填“>”、“<”或“=”)。
③ 在一定温度下,提高反应③中NO 转化率可采取的措施是 _____。
(2)利用电化学装置可消除氮氧化物污染,变废为宝。

① 图Ⅰ装置实现的能量转化形式是_____。石墨Ⅱ电极上发生的电极反应方程式为_____。相同条件下,放电过程中消耗的NO2和O2的体积比为_____。
② 图Ⅱ为电解NO制备NH4NO3的装置。该装置中阳极的电极反应式为_____。“反应室”中发生反应的离子方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com