
科目: 来源: 题型:
【题目】下列说法不正确的是
A.工业用焦炭在高温下还原二氧化硅制得高纯硅
B.SiO2可用于制造光导纤维
C.钠是一种强还原剂,可以把钛、锆、铌等从其熔融盐中置换出来
D.氧化镁熔点高达250℃,是优质的耐高温材料
查看答案和解析>>
科目: 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g)。
H2(g)+I2(g)。
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=3mol·L-1,则此温度下反应①的平衡常数为
A. 9 mol2·L-2B. 12 mol2·L-2C. 16 mol2·L-2D. 20 mol2·L-2
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)B具有的性质是_____(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:__________
(2)只用一种试剂就能将B、C、D鉴别出来,这种试剂可以是_______
①酚酞试液 ②氢氧化钠溶液 ③碳酸钠溶液 ④水 ⑤溴水
(3)C与D反应能生成相对分子质量为100的酯,其化学方程式为:______
查看答案和解析>>
科目: 来源: 题型:
【题目】以硅孔雀石[主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:

已知:SOCl2+H2O![]() SO2↑+2HCl↑
SO2↑+2HCl↑
(1)“酸浸”时盐酸与CuCO3·Cu(OH)2反应的化学方程式为_________________。
检验“酸浸”后浸出液中的Fe3+可用____________溶液。
(2)“氧化”时发生反应的离子方程式为____________________________。
(3)“滤渣2”的主要成分为________(填化学式);“调pH”时,pH不能过高,其原因是________________。
(4)“加热脱水”时,加入SOCl2的目的是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】MnO2 和 Zn 是制造普通干电池的重要原料,现用软锰矿(主要成分为 MnO2)和闪锌矿(主要成分为 ZnS)制备MnO2和Zn的工艺流程如下:
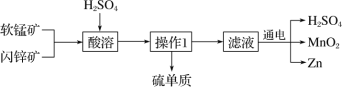
下列说法不正确的是( )
A. 酸溶时,ZnS 作还原剂 B. 原料硫酸可以循环使用
C. 操作 1 是萃取 D. 不可用盐酸代替硫酸进行酸溶
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点:33℃,沸点:73℃。实验室可用如图装置制取ICl3。
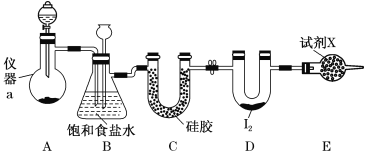
(1)仪器a的名称是________。
(2)制备氯气选用的药品为漂白精固体[主要成分为Ca(ClO)2]和浓盐酸,相关反应的化学方程式为__________________________________。
(3)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时装置B中的现象:____________________________________________。
(4)试剂X为________________。
(5)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为________________。
(6)500 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管,170℃下充分反应,用水-乙醇混合液充分溶解产物I2,定容到100 mL。取25.00 mL用0.0100 mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00 mL,则样品中CO的体积分数为________。(保留三位有效数字)(已知:气体样品中其他成分与I2O5不反应;2Na2S2O3+I2===2NaI+Na2S4O6)
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A. 标准状况下,2.24L 四氯化碳含有的分子数目为 0.1NA
B. 25℃时,0.1 mol·L-1Na2S溶液中含有Na+的数目为0.2NA
C. 64g的SO2与足量的O2充分反应后可得到NA个SO3分子
D. 2.3gNa与O2完全反应生成3.6g产物时失去的电子数为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某元素的一种同位素X原子的质量数为A,它与2H原子组成2HmX分子,此分子含N个中子,在a g 2HmX中所含电子的物质的量是
A. ![]() (A-N+m) molB.
(A-N+m) molB. ![]() (A-N) mol
(A-N) mol
C. ![]() (A-N+m) molD.
(A-N+m) molD. ![]() (A-N+2m) mol
(A-N+2m) mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com