
科目: 来源: 题型:
【题目】某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属,保护环境。
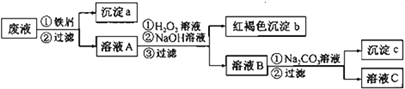
请回答:
(1)沉淀a中含有的单质是_____________。
(2)沉淀c的化学式是___________________。
(3)溶液A与H2O2溶液在酸性条件下反应的离子方程式是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:

回答下列问题:
(1)葡萄糖的实验式为_________________________________。
(2)E中含有的官能团为羟基、醚键和__________________________。
(3)由B到C的反应类型为_____________________。
(4)C的结构简式为_____________________。
(5)由D到E的反应方程式为____________________________________。
(6)F是B的同分异构体,7.30g的F与足量饱碳酸氢钠反应可释放出2.24L二氧化碳(标准状况),F的可能结构共有__________种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构简式为_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关下图装置的叙述正确的是

A. 溶液中Na+向Fe极移动
B. 该装置中Pt为正极,电极反应为:O2 + 2H2O + 4e===4OH
C. 该装置中Fe为负极,电极反应为:Fe2e===Fe2+
D. 该原电池装置最终的产物是Fe(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】铬元素及其化合物在生产、生活中具有广泛的用途。以某铬矿石(主要成分是Cr2O3,含Fe2O3、SiO2等杂质)为原料生产Cr2O3的流程如下:
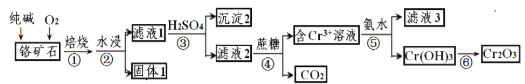
已知:2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2,焙烧时SiO2也参与反应。
4Na2CrO4+4CO2,焙烧时SiO2也参与反应。
(1)Cr(OH)3和Al(OH)3性质类似,则Cr(OH)3与KOH反应的离子方程式为_________________;
(2)沉淀2的化学式为__________;
(3)步骤③中CrO42-转化成Cr2O72- ,写出其离子方程式____________________,硫酸能否换成盐酸并说明其理由___________________;
(4)滤液3中的主要溶质是两种盐,其化学式为__________________________;
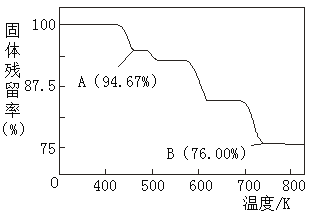
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示,则B点时铬的氧化物化学式为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF | 可溶 |
A13+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.60×10-6 |
(1)调节pH步骤中,溶液pH的调节范围是______________。
(2)滤渣1和滤渣3主要成分的化学式分别是_____________、__________________。
(3)酸浸过程中,1 molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式________________________________。
(4)沉镍过程中,若c(Ni2+)=2.0mol·L-1,欲使100mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1,则需要加入Na2CO3固体的质量最少为_________g。(保留小数点后1位有效数字)。
(5)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间为_______________。

查看答案和解析>>
科目: 来源: 题型:
【题目】CaCO3与稀盐酸反应生成CO2的量与反应时间的关系如图所示。下列结论不正确的是
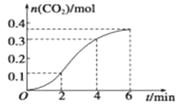
A. 反应在2~4 min内平均反应速率最大
B. 反应开始4 min内温度比浓度对反应速率的影响大
C. 4 min后,反应速率减小的主要原因是c(H+)减小
D. 反应在2~4 min内生成CO2的平均反应速率为v(CO2)=0.1 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 加热条件下,1 mol O2与Li完全反应转移的电子数目为2NA
B. 25℃时,100mLpH=l的硫酸溶液中含有的氢离子数目为0.02NA
C. 4.4 g乙醛和乙酸乙酯的混合物中含有的氢原子数目为0.4NA
D. 15 g 14C16O中含有的质子数目为8NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在实验报告中有以下实验数据,其中数据合理的是( )
A.500 mL容量瓶配制250 mL 0.1mol/L NaCl溶液
B.用量筒量取5.26 mL盐酸
C.用广泛pH试纸测得溶液的pH是3.5
D.用25 mL滴定管量出15.80 mL的NaOH溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+ NaClO=Na2CO3+N2H4·H2O+NaCl。据此,某学生设计了下列实验。
I、制备 NaClO溶液
实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
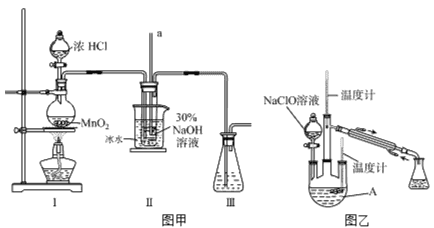
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_____________________________。
Ⅱ、制取水合肼
实验装置如上图图乙所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式________________________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
(4)称取馏分0.3000g,加水配成20.0mL溶液,一定条件下用0.1500mol·L-1的I2溶液滴定。
已知:N2H4·H2O +2I2=N2↑+4HI+H2O
①滴定时,可以选用的指示剂为____________________;
②实验测得消耗I2溶液的平均值为20.00L,馏分中N2H4·H2O的质量分数为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,下列说法正确的是( )
CH3COOH+OH-,下列说法正确的是( )
A. 加入少量固体FeCl3, c(CH3COO-)增大
B. 加入少量NaOH固体,c(CH3COO-)增大
C. 稀释溶液,溶液的pH增大
D. 加入适量醋酸得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com