
科目: 来源: 题型:
【题目】A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)这四种元素分别是:A________,B________,C________,D________。(填名称)
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是____________。
(3)A与B形成的三原子分子的电子式是________, B与D形成原子个数比为1∶1的化合物的电子式是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究发现,由钴氧化物负载的锰氧化物纳米粒子催化剂对某些反应具有高活性,应用前景良好。回答下列问题:
(1)Mn基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是________;Mn与Co相比,基态原子核外未成对电子数较少的是_______。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)沸点相比较:
①甲醇____H2O(填写“>”“<”或“=”);原因是_____________________________;
②CO2____H2(填写“>”“<”或“=”);原因是________________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了π键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为αnm,则r(O2-)为________ nm (用含α的算式表示,不必运算化简,下同)。MnO也属于NaCl型结构,晶胞参数为αˊnm,则r(Mn2+)为________nm(用含α、αˊ的算式表示)。
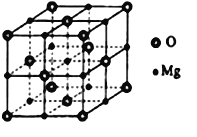
查看答案和解析>>
科目: 来源: 题型:
【题目】全钒液流储能电池一次性充电后,续航能力可达1000km,而充电时间只需3~5min,被誉为“完美电池”,其原理如图所示(已知V2+呈紫色,V3+呈绿色)。电池放电时,左槽溶液质量增加。下列说法正确的是

A. 充电时的阴极反应为VO2++2H++e-=VO2++H2O
B. 放电时的正极反应为V3++e-=V2+
C. 放电过程中,右槽溶液由紫色变为绿色
D. 若负载为用石墨电极电解食盐水的装置,生成4gNaOH时该电池中消耗0.1molH+
查看答案和解析>>
科目: 来源: 题型:
【题目】铬合金有重要的用途,从其废料中制取铬的流程如下:
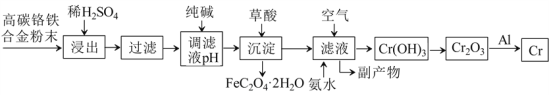
已知: ① Cr+H2SO4=CrSO4+H2↑,
② 流程中铬元素浸出之后至生成Cr(OH)3之间均以自由移动离子状态存在于溶液中。
请回答下列问题:
(1)稀硫酸酸浸过程中,提高“浸出率”的措施有:________________________ (写一条即可) 。
(2)用纯碱调节滤液pH,得到某弱碱沉淀,若纯碱过量,则可能导致的后果是_:_____________。
(3)流程中的“副产物”中,可用作可溶性钡盐中毒解毒剂的物质的化学式是___________;可用作化肥的物质的化学式是_____________。
(4)加入草酸实现沉淀转化反应化学方程式为:_______________________________________。
(5)流程中利用铝热反应冶炼铬的化学方程式为:_____________________________________。
(6)流程中由滤液生成Cr(OH)3的化学方程式为:_____________________________________。
(7)除已知反应①之外,整个流程中涉及的主要氧化还原反应有_____个,分解反应有____个。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
① CO(g)+2H2(g)![]() CH3OH(g) ΔH1 =-99kJ·mol-1
CH3OH(g) ΔH1 =-99kJ·mol-1
② CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)CO2的电子式是________________。
(2)ΔH3=______kJ·mol-1,②反应正向的熵变ΔS______0(填“>”“<”或“=”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图。
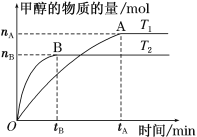
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=_____ mol·L-1·min-1。
②图示的温度T1______T2(填写“>”、“<”或“=”)
(4)T1温度时,将2 mol CO2和6 mol H2充入2 L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,此时容器内的压强与起始压强之比为________;反应②在该温度达到平衡时,其平衡常数的数值为_______。
(5)若反应②在原电池条件下实现,请写出酸性条件下惰性电极上由CO2生成CH3OH的电极反应式:____________________,该电极为原电池的_______极。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列金属冶炼的反应原理,错误的是( )
A. MgCl2(熔融)![]() Mg+Cl2↑ B. 2NaCl+H2
Mg+Cl2↑ B. 2NaCl+H2![]() 2Na+2HCl
2Na+2HCl
C. Fe3O4+4CO![]() 3Fe+4CO2 D. 2HgO
3Fe+4CO2 D. 2HgO![]() 2Hg+O2↑
2Hg+O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于氨的叙述中,错误的是( )
A.氨易液化,因此可用作制冷剂
B.氨易溶解于水,因此可用来做喷泉实验
C.氨极易溶解于水,因此氨水比较稳定(很难分解)
D.氨溶解于水显弱碱性,因此可使酚酞试剂变为红色
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用稀硝酸与铜反应制备NO气体,如果采用图Ⅰ装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不是十分理想,因为观察到的现象不能有力证明反应产物是NO。有人设计了图Ⅱ装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果。
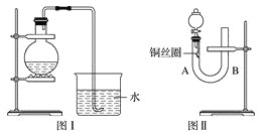
(1)用图Ⅰ装置做实验时,用排水法收集到的气体的颜色为_____色;实验过程中由于______,不易观察到____________生成,从而不能有力证明反应产物是NO。
(2)用图Ⅱ装置做实验时,将有关操作补充完全:
①将分液漏斗的活塞打开,从U形管的B侧管口注入稀硝酸,一直注到____________为止。
②关闭活塞,用酒精灯在U形管的A侧加热,当______时,立即撤去酒精灯。
(3)根据图Ⅱ装置的实验完成下列问题:
①反应在什么情况下可以自动停止?________________________。
可在何处观察到无色的NO气体?____________________________________________。
②如果将分液漏斗的活塞慢慢打开,可立即观察到哪些明显现象?_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com