
科目: 来源: 题型:
【题目】工业上利用β-锂辉矿(LiAlSi2O6和少量MgO、CaCO3杂质)制备金属锂,工艺流程如下:

回答下列问题:
(1)β-锂辉矿的主要成分LiAlSi2O6中存在的原子团为_____________。
(2)工业上加快酸浸速率除调整硫酸浓度、升高温度外还可以采取的措施为_____________。浸出液中加入CaCO3的主要作用为______________________。
(3)一定温度下,Ksp(CaCO3)=2.5×10-9,Ksp(Li2CO3)=1.6×10-3,若反应Ⅱ的溶液中c(Ca2+)和c(Li+)均为1.0mol·L-1,则开始滴加稀Na2CO3溶液时,理论上c(CO32-)应控制的范围为_________;实际操作中CaCO3和Li2CO3可能同时析出,从而造成Li+损失,一种改进的工艺是利用草酸钠代替Na2CO3作为沉淀剂,分析使用草酸钠的原因为_____________________。
(4)反应Ⅲ的离子方程式为_______________________。常温下,Na2CO3的溶解度为29.4g,判断反应Ⅲ能否使溶液中Li+沉淀完全?_______________________________________________________(列式计算)。[化学上规定,当某离子浓度≤10-5mol·L-1时即可认为该离子沉淀完全]
(5)高温下发生反应Ⅳ的化学方程式为_____________________________________________。
(6)一定温度下,LiAlSi2O6与不同浓度的硫酸反应30min时结果如下表所示:
c(H2SO4)/mol·L-1 | 1.0 | 5.0 | 10.0 | 16.0 | 18.0 |
Li浸出率/% | 30 | 60 | 90 | 80 | 70 |
Al浸出率/% | 30 | 60 | 40 | 10 | 0 |
试分析酸浸过程中,若使c(H2SO4)=10.0mol·L-1,则该工艺条件的优缺点为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、R、I、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,I的原子序数是W的两倍,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
(1)Q+核外电子排布式为___________,Y的电子排布图为_________________________
(2)化合物ZX3中Z原子的杂化方式为___________,ZW2- 离子的立体构型是___________;
(3)①Y、R的最高价氧化物的沸点较高的是___________(填化学式),原因是___________;
②W与I的简单氢化物中W的熔沸点更高,原因是______________________
(4)向Q元素的硫酸盐溶液中通入足量ZX3,充分反应后溶液呈深蓝色,该反应的离子方程式为__________________________________________________;
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为___________,Y原子的配位数为___________,若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则阿伏加德罗常数的数值为___________(用含a和ρ的代数式表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:

(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) ______________________。
(2)①电解饱和食盐水的化学反应方程式为______________。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,写出用SO2吸收发生的离子方程式_________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为__________________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_____________;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,最终用_____________方法得到单质Br2。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是制取、洗涤并测量生成气体体积的装置示意图,利用上述装置进行下表所列实验,能达到试验目的是( )
物质实验 | a(液体) | b(固体) | c(液体) |
A | 稀盐酸 | 锌粒 | 浓H2SO4 |
B | 浓盐酸 | MnO2 | 浓H2SO4 |
C | 稀硫酸 | CaCO3 | 浓H2SO4 |
D | 浓氨水 | 生石灰 | 浓H2SO4 |

A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】扑热息痛是一种优良的解热镇痛药,其结构简式为 ,下列说法不正确的是( )
,下列说法不正确的是( )
A. 它能与烧碱溶液反应
B. 它能与溴水发生取代反应
C. 该物质是由两分子氨基酸脱水缩合而成
D. 它遇FeCl3溶液发生显色反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关一定物质的量浓度溶液的配制说法中正确的是 ( )
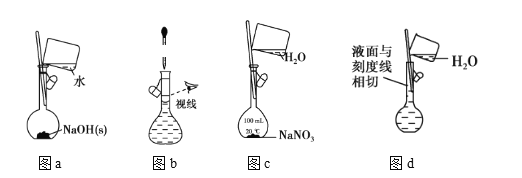
(1)为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用胶头滴管滴加蒸馏水至刻度线
(2)利用图a配制0.10molL-1NaOH溶液
(3)利用图b配制一定浓度的NaCl溶液
(4)利用图c配制一定物质的量浓度的NaNO3溶液
(5)用容量瓶配制溶液时,若加水超过刻度线,立即用滴管吸出多余液体
(6)配制溶液定容时,仰视视容量瓶刻度会使溶液浓度偏低
(7)配制溶液的定容操作可以用图d表示
A. ⑵⑸ B. ⑴⑹ C. ⑴⑷⑹ D. ⑴⑶⑸
查看答案和解析>>
科目: 来源: 题型:
【题目】含氮化合物在材料方面的应用越来越广泛。
(1)甲胺(CH3NH2)是合成太阳能敏化剂的原料。工业合成甲胺原理:
CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。
CH3NH2(g)+H2O(g)△H。
①已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 | C-H | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的△H=______________。
②一定条件下,在体积相同的甲、乙、丙、丁四个容器中,起始投入物质如下:
NH3(g)/mol | CH3OH(g)/mol | 反应条件 | |
甲 | 1 | 1 | 498K,恒容 |
乙 | 1 | 1 | 598K,恒容 |
丙 | 1 | 1 | 598K,恒压 |
丁 | 2 | 3 | 598K,恒容 |
达到平衡时,甲、乙、丙、丁容器中的CH3OH转化率由大到小的顺序为_______________。
(2)工业上利用镓(Ga)与NH3在高温下合成固体半导体材料氮化镓(GaN),其反应原理为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
①在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。图中A点与C点的化学平衡常数分别为KA和KC,下列关系正确的是_________(填代号)。

a.纵轴a表示NH3的转化率 b.纵轴a表示NH3的体积分数 c.T1<T2 d.KA<Kc
②镓在元素周期表位于第四周期第ⅢA族,化学性质与铝相似。氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,该反应的离子方程式为_____________________。
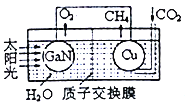
(3)用氮化镓与铜组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成CH4。铜电极表面发生的电极反应式为___________。两电极放出O2和CH4相同条件下的体积比为________,为提高该人工光合系统的工作效率,可向装置中加入少量的__________(填“盐酸”或“硫酸”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(4分)下列应用不涉及氧化还原反应的是( )
A. Na2O2用作呼吸面具的供氧剂
B. 工业上电解熔融状态的Al2O3制备Al
C. 工业上利用合成氨实现人工固氮
D. 实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
科目: 来源: 题型:
【题目】0.096 kg碳完全燃烧可放出3 147.9 kJ的热量 ,则下列热化学方程式正确的是( )
A. C(s)+O2(g)=CO2(g) ΔH=—393.49 kJ/mol
B. C+O2=CO2 ΔH=-393.49 kJ/mol
C. C(s)+O2(g)=CO2(g) ΔH=+393.49 kJ/mol
D. C(s)+![]() O2(g)=CO(g) ΔH=-393.49 kJ/mol
O2(g)=CO(g) ΔH=-393.49 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com