
科目: 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下述为制取Cu2O的两种方法:
方法a:用炭粉在高温条件下还原CuO
方法b:电解法,反应为2Cu+H2O![]() Cu2O+H2↑
Cu2O+H2↑
(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s)△H1=akJ/mol
O2(g)=Cu2O(s)△H1=akJ/mol
②C(s)+![]() O2(g)=CO(g) △H2=bkJ/mol
O2(g)=CO(g) △H2=bkJ/mol
③Cu(s)+![]() O2(g)=CuO(s)△H3=ckJ/mol
O2(g)=CuO(s)△H3=ckJ/mol
则方法a中反应的热化学方程式是:_________________。
(2)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度而制备纳米Cu2O装置如图所示:
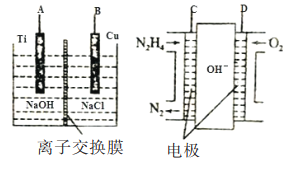
①如图装置中D电极应连______电极。(填“A”或“B”)
②该离子交换膜为______离子交换膜(填“阴”或“阳”),该电解池的B极反应式为:______。
③C极反应式为:__________。
(3)在相同体积的恒容密闭容器中,用以上方法制得的两种Cu2O分别进行催化分解水的实验:
2H2O![]() 2H2(g)+O2(g) △H>0,水蒸气的浓度随时间t变化如表所示:
2H2(g)+O2(g) △H>0,水蒸气的浓度随时间t变化如表所示:
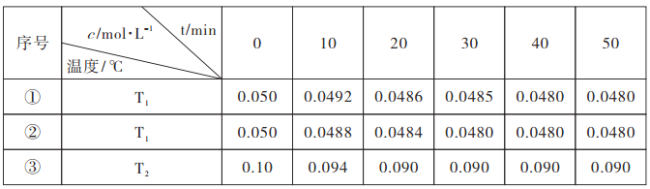
根据上述数据分析:
①催化剂的效率:实验①_______实验②(填“>”或“<”);
②通过实验①、③分析,T1______T2(填“>”或“<”);
③实验①、②、③的化学平衡常数K1、K2、K3的大小关系为:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】酪氨酸是一种生命活动不可缺少的氨基酸,它的结构简式如下:
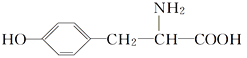
(1)酪氨酸能发生的化学反应类型有________(填字母)。
A.取代反应 B.氧化反应
C.酯化反应 D.中和反应
(2)在酪氨酸的同分异构体中,同时满足如下三个条件的,除酪氨酸外还有________种。
①属于氨基酸且“碳骨架”与酪氨酸相同;②与氯化铁溶液能发生显色反应;③氨基(—NH2)不与苯环直接相连。
(3)已知氨基酸能与碱反应,写出酪氨酸与足量的NaOH溶液反应的化学方程式:___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】KMnO4在生产和生活中有着广泛的用途。某化学小组在实验室制备KMnO4并探究其性质。请回答下列问题:
(一)KMnO4的制备。
步骤I 先利用如图甲所示装置由MnO2制备KMnO4。
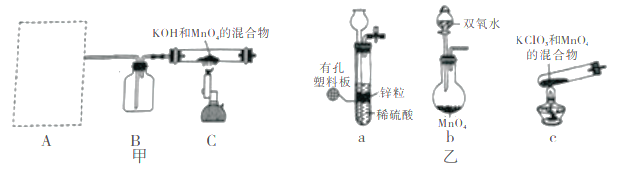
(1)装置A应选用图乙中的_______(填“a”“b”或“c”)。
(2)装置B中所盛试剂的名称为________。
(3)装置C处制备K2MnO4的化学方程式为________。
步骤II 由K2MnO4制备KMnO4。已知:K2MnO4易溶于水,水溶液呈墨绿色。主要过程如下:
①充分反应后,将装置C处所得固体加水溶解,过滤;
②向①的滤液中通入足量CO2,过滤出生成的MnO2;
③将②的滤液经过蒸发浓缩、降温结晶、过滤、洗涤、干燥等一系列实验操作,得KMnO4晶体。
(4)过程②向①的滤液中通人足量CO2,其还原产物为_______。
(5)过程③干燥KMnO4时,温度不宜过高的原因是__________。
(二)KMnO4的性质。
KMnO4具有强氧化性。某化学学习小组利用其性质测定H2C2O4溶液的浓度。
反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(6)①滴定终点现象是:当加入最后一滴酸性KMnO4溶液时,溶液颜色______,且半分钟内不褪色。
②c(标准KMnO4溶液)=0.20mol/L,滴定时所得的实验数据如下表,试计算所测H2C2O4溶液的浓度为_______mol/L。
实验次数编号 | 待测液体积(mL) | 滴入的标准液体积(mL) |
1 | 10.00 | 22.95 |
2 | 10.00 | 20.05 |
3 | 10.00 | 19.95 |
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硫是造成大气污染的主要有害气体之一,二氧化硫尾气处理的方法之一是采用钠一钙联合处理法。
第一步:用NaOH溶液吸收SO2。2NaOH+SO2=Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应。Na2SO3+CaO+H2O=CaSO3↓+2NaOH
完成下列填空:
(1)在上述两步反应所涉及的短周期元素中,原子半径由小到大的顺序是_______(用元素符号填写)。
(2)氧和硫属于同族元素,写出一个能比较氧元素和硫元素非金属性强弱的化学反应方程式:_______________________________________。
(3)NaOH的电子式为______________ 。
(4)若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的化学方程式______________。
(5)钠一钙联合处理法的优点有________________。(任写一点即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是可逆反应X2+3Y2 ![]() 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是
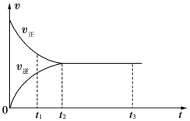
A. t1时,只有正方向反应
B. t2~t3,反应仍在进行
C. t2时,反应到达限度
D. t2~t3,各物质的浓度不再发生变化
查看答案和解析>>
科目: 来源: 题型:
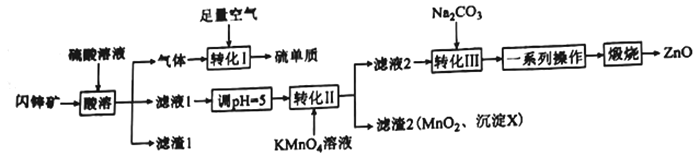
【题目】ZnO在医药、石化等领域有广泛的用途。研究小组用某闪锌矿(主要成分ZnS,含有FeS、SiO2、MnCO3等杂质)制备氧化锌和硫单质,设计如下流程:
请回答下列问题:
(1)滤渣1的化学式为____________________,任写一种该物质的用:______________________。
(2)沉淀X的化学式为_______________________________。
(3)“转化I”中氧化剂和还原剂的物质的量之比为________________________。
(4)“转化II”中主要反应的离子方程式为_____________________________________。
(5)若Ksp(ZnCO3)=1.5×10-10,溶液中离子浓度≤1.0×10-5 mol/L时,认为该离子沉淀完全。则欲使1 L c(Zn2+)=1.5 mol/L溶液中Zn2+沉淀完全,需加入等体积的Na2CO3溶液的物质的量浓度至少为____________________(列出计算式,溶液混合时体积变化忽略不计)。
(6)“一系列操作”包括过滤、洗涤、干燥。过滤所用的玻璃仪器有___________________________;洗涤沉淀的操作为______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是
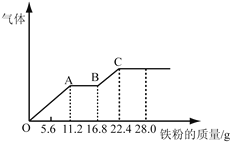
A. 混合酸中HNO3物质的量浓度为2mol/L
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C. 原混合酸中H2SO4物质的量为0.4 mol
D. 第二份溶液中最终溶质为FeSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HX溶液与NH3·H2O溶液按不同体积比混合,保持Va+Vb=100mL(溶液体积有简单叠加),Va、Vb与混合液的pH的关系如图所示。下列说法不正确的是

A. Ka(HX)的值与Kb(NH3·H2O)的值相等
B. c、d两点,![]() 值相等
值相等
C. a→d点过程中,存在c(X-)=c(NH4+)
D. b点,c(NH4+)+c(HX)=0.05mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com