
科目: 来源: 题型:
【题目】某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。
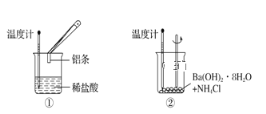
(1)实验发现,装置②中反应后溶液的温度________。
a.升高 b.降低 c.不变
(2)装置①中发生的反应,反应物的总能量比生成物的总能量_________。
a.高 b.低 c.相等
(3)已知断裂1 mol共价键需要吸收的能量分别为H-H:436kJ,I-I:151 kJ,H-I:299kJ。则反应H2+I2=2HI的能量变化为_______。
a.吸热 b.放热 c.无能量变化
(4)碱金属单质在空气中燃烧的产物与碱金属的活泼性有关。若某同学做了锂单质在空气中燃烧的实验,他得到的产物应为_____。(填化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场 “革命”。它的制备方法如下图所示,下列说法正确的是
![]()
A. 步骤①的化学方程式为:SiO2+C![]() Si+CO2↑
Si+CO2↑
B. 灼烧熔融的Na2CO3固体,可用石英坩埚
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点67.6℃),可通过蒸馏(或分馏)提纯SiHCl3
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法不正确的是
A. 23g Na与O2充分反应生成Na2O和Na2O2的混合物,消耗O2的分子数N(O2)的范围为:0.25 NA< N(O2)< 0.5 NA
B. 2 mol NO和1 mol O2在密闭容器中充分反应,反应后容器中的分子数小于2NA
C. 2.5gMg-Zn合金与足量盐酸反应,放出的气体在标况下的体积可能为2.24L
D. 50 mL 18.4 mol/L浓硫酸与足量铜微热反应,转移的电子数目为0.92NA
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是( )
A. 0.1molL-1NaHCO3溶液中:C(Na+)+C(H+)=C(HCO3-)+C(CO32-)+C(OH-)
B. Na2CO3溶液中:C(OH-)=C(H+)+C(HCO3-)+2C(H2CO3)
C. Na2S溶液中:2C(Na+)= C(S2-)+C(HS-)+C(H2S)
D. pH相同的①CH3COONa、②NaOH、③NaClO三种溶液的c(Na+):③>①>②
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中,正确的是
A.1 mol O3的质量为 32 gB.SO42-的摩尔质量为96 g/mol
C.0.05mol HCl的体积是1.12LD.0.5mol/L Al2(SO4)3溶液中含Al3+的个数约为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)NH3经一系列反应可以得到HNO3和NH4NO3,如图所示,

在Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是:__________________________

(2)Ⅱ中,2NO(g)+ O2(g) 2NO2(g).在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图).
①p1、p2的大小关系p1 ________ p2(填大于、等于、小于) .
②随温度升高,该反应平衡常数变化的趋势是_________________________
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(1)再制备浓硝酸.
N2O4与O2, H2O化合的化学方程式是______________________________
(4)Ⅳ中,电解NO制备NH4NO3,其原理原理如下图所示,为使电解产物全部转化为NH4NO3, 需补充物质___________ ,说明理由:___________________.
 .
.
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.实验室常用以下几种方法制取氯气。
(1)二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式__________________。
(2)高锰酸钾与浓盐酸反应制氯气,写出其反应的化学方程式________。
(3)氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为____。
Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数的测定。
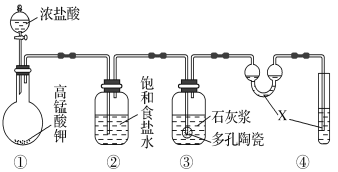
(1)装置④中的X试剂为_____________________。
(2)装置③中发生反应的化学方程式为_______________________,
(3)测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.100 0 mol·L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:
3ClO-+I-===3Cl-+IO
IO+5I-+3H2O===6OH-+3I2
实验测得数据如下表所示。
滴定次数 | 1 | 2 | 3 |
KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为________;若滴定过程中未充分振荡溶液,局部变浅蓝色时就停止滴定,则测定结果将________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,

下列说法错误的是
A. B极为原电池的正极
B. A、B、C可能分别为Zn、Cu、稀盐酸
C. C中阳离子向A极移动
D. A极发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com