
科目: 来源: 题型:
【题目】X、Y、Z、W为前20号原子序数依次递增的四种元素,X与Y能形成![]() 和
和![]() 两种常温下呈液态的化合物,Z原子的原子序数为最外层电子数的3倍,等物质的量的单质W所含电子数为化合物
两种常温下呈液态的化合物,Z原子的原子序数为最外层电子数的3倍,等物质的量的单质W所含电子数为化合物![]() 电子数的两倍,则以下说法错误的是
电子数的两倍,则以下说法错误的是
A. 氢化物的稳定性为![]()
B. ![]() 的电子式为
的电子式为![]()
C. ![]() 中既含有共价键又含有离子键
中既含有共价键又含有离子键
D. ![]() 能与
能与![]() 反应生成
反应生成![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示装置在中学实验中有很多用途,可根据实验目的在广口瓶中盛放适量某试剂。下面有关其使用有误的是( )

A. 瓶内装饱和食盐水,可用于除去氯气中的HCl气体,气体应a进b出
B. 瓶内装水,可用于除去NO气体中的NO2气体,气体应a进b出
C. 瓶口朝上,可用于收集NH3,气体应b进a出
D. 瓶口朝下,可用于收集CH4气体,气体应b进a出
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某化学小组制备氢氧化铁胶体:在洁净的小烧杯中盛适量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和FeCl3溶液,至液体呈红褐色,停止加热。制备氢氧化铁胶体的化学反应方程式是________________________。
(2)如图所示是中学化学中常用于混合物分离和提纯的装置:
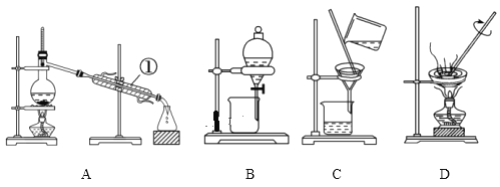
请根据装置图回答下列问题:
①从氯化钾溶液中得到氯化钾固体选择装置_________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质得到蒸馏水选择装置_________;从碘水中提取碘选择装置_________。
②装置A中①的名称是____________,冷凝水流动的方向是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3 = 2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
A.CO2+H2O +2NaClO = Na2CO3+2HClO
B.CO2+H2O +NaClO = NaHCO3+HClO
C.CO2 +H2O +C6H5ONa![]() NaHCO3+C6H5OH
NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa![]() Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH![]() NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F.CH3COOH+NaCN = CH3COONa+HCN
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是_________(填编号),其pH值为_______(填数值);pH最大的是________(填编号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
请根据上述反应,总结出复分解反应发生的另一规律:_____________________。
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是____________________,反应的离子方程式为____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
试回答下列问题:
(1)当反应①转移3摩尔电子时,消耗H2SO4的质量是______g,产生氢气的体积(标准状况)_________L。
(2)反应②中_________作氧化剂,___________是氧化产物。
(3)当反应②中生成11.2LSO2气体(标准状况下)时,被还原的H2SO4的物质的量是____________。
(4)用单线桥法表示反应②电子转移的方向和数目(在化学方程式上标出)。___________
Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
(5)反应③中氧化产物与还原产物的物质的量之比为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2SO3是一种重要的还原剂,I2O5是一种重要的氧化剂,二者都是化学实验室中的重要试剂。
(1)已知:2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1,O2(g)![]() O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
(2)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k·ca(SO32-)·cb(O2),k为常数。
①当溶解氧浓度为4.0 mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO32-)与速率数值关系如下表所示,则a=____。
c(SO32-)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
V×106 | 10.2 | 24.4 | 44.7 | 103.6 |
②两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知1n(k2/k1)=Ea/R(1/T2-1/T1),R 为常数,则Ea(富氧区)______(填“>”或“<”)Ea(贫氧区)。
反应阶段 | 速率方程 | k(297.0K)/k(291.5K) |
富氧区 | v= k·c(SO32-)·c(O2) | 1.47 |
贫氧区 | v= k·ca(SO32-)·cb(O2) | 2.59 |
(3)等物质的量的Na2SO3和Na2SO4混合溶液中,c(SO32-) +c( HSO3-)______(填“>”“<”或“=”)c(SO42-)。
(4)利用I2O5可消除CO 污染,其反应为I2O5(s)+5CO(g) ![]() 5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。

①从反应开始至a点时的平均反应速率v(CO)=__________。
②b点时,CO 的转化率为_____________。
③b点 和 d点 的 化学 平衡常数:Kb____(填“ >”“<”或“=” )Kd,判断的理由是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯乙烯(![]() )是合成橡胶和塑料的重要单体,也是生产某些药物、农药的中间体。化合物E是一种昆虫信息素,可以通过以下流程制备。
)是合成橡胶和塑料的重要单体,也是生产某些药物、农药的中间体。化合物E是一种昆虫信息素,可以通过以下流程制备。

完成下列填空:
(1)反应②的反应类型__________;上述流程中的物质,与B互为同分异构体是__________。写出B的属于芳香烃的一种同分异构体的结构简式__________,该物质的名称为_________。
(2)反应①中,A和苯按摩尔比1:1完全反应,产物只有B。写出A的结构简式___________。
(3)写出反应③的化学方程式____________________________________。
(4)以B为原料制取C的反应是可逆反应,分离C、B混合物的实验操作为____________。
(5)苯乙烯露置于空气中可被氧化为苯甲醛和甲醛。设计实验方案检验苯乙烯样品是否被氧化变质______________________________________。
(6)参照上述合成路线的表示方法,设计以苯乙烯为原料经过三步反应制备新型高分子导电材料PPA(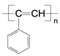 )的合成路线,并注明必要的反应条件。(无机物任选)_____________
)的合成路线,并注明必要的反应条件。(无机物任选)_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】苯乙烷(![]() -C2H5)可生产塑料单体苯乙烯(
-C2H5)可生产塑料单体苯乙烯(![]() -CH=CH2),其原理反应是:
-CH=CH2),其原理反应是:![]() -C2H5(g)
-C2H5(g) ![]()
![]() -CH=CH2(g) + H2(g);△H = +125 kJ·mol-1。某温度下,将0.40 mol
-CH=CH2(g) + H2(g);△H = +125 kJ·mol-1。某温度下,将0.40 mol![]() -C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
-C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n( | 0.40 | 0.30 | 0.26 | n2 | n3 |
n( | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)n1=__________mol,计算该反应的平衡常数,K=___________。
(2)工业上常以高温水蒸气作为反应体系的稀释剂(不参与反应)。![]() -C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图所示。当其它条件不变时,水蒸气的用量越大,平衡转化率将_________(填“越大”、“越小”或“不变”),原因是____________。
-C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图所示。当其它条件不变时,水蒸气的用量越大,平衡转化率将_________(填“越大”、“越小”或“不变”),原因是____________。

(3)副产物H2用做氢氧燃料电池。写出酸性条件下,该电池正极的电极反应式__________。
(4)在相同条件下,若最初向该容器中充入![]() -CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图中画出并标明该条件下
-CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图中画出并标明该条件下![]() -C2H5(g)和
-C2H5(g)和![]() -CH=CH2(g)的浓度c随时间t变化的曲线_____。
-CH=CH2(g)的浓度c随时间t变化的曲线_____。
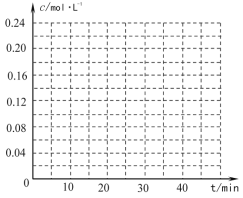
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com