
科目: 来源: 题型:
【题目】在农村,有些地区由于使用了没有保护措施的铁制自来水管,导致水中含有Fe3+,用这种水泡的茶,茶水的颜色略带黑色。我们可以在这种水中加入下列哪种溶液使得溶液呈红色来检验Fe3+( )
A.K2SB.KCNC.KSCND.KCl
查看答案和解析>>
科目: 来源: 题型:
【题目】A是一种常见的单质,B、C为常见的化合物,A、B、C均含有元素x,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列说法中正确的是( )
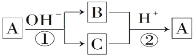
A. 反应①和②一定为氧化还原反应
B. 反应①和②互为可逆反应
C. X元素可能是金属,也可能是非金属
D. X元素可能为铝
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,不能按![]() (“→”表示一步完成)的关系相互转化的是( )
(“→”表示一步完成)的关系相互转化的是( )
选项 | a | b | c |
A | Fe | FeCl2 | FeCl3 |
B | Si | SiO2 | SiF4 |
C | HNO3 | NO | NO2 |
D | Al | Al2O3 | Al(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
① H2(g) +I2(?)![]() 2HI(g) △Hl=-9.48kJ/mol
2HI(g) △Hl=-9.48kJ/mol
②H2(g) +I2(?)![]() 2HI(g) △H2=+26.48kJ/mol
2HI(g) △H2=+26.48kJ/mol
下列判断不正确的是
A. ①中的I2为气态,②中的I2为固态
B. ②的反应物总能量比①的反应物总能量低
C. 反应①的产物比反应②的产物热稳定性更好
D. lmol固态碘升华时将吸热35.96kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
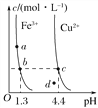
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
科目: 来源: 题型:
【题目】0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各为0.4mol。将A通入溴的四氯化碳溶液中,溶液褪色(反应原理与通入溴水一样),试回答:
(1)烃A的结构式为_________________________________。
(2)将A通入溴的四氯化碳溶液中,有关反应的方程式为_______________________。
(3)有机物B比A在分子组成上多一个CH2原子团,结构与A相似。写出B在一定条件下生成高分子化合物的化学方程式________________________________________________。
(4)写出苯与液溴反应的化学方程式_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
A. 稀释溶液,水解平衡常数增大
B. Ksp(CuS)<Ksp[Cu(OH)2]
C. 升高温度![]() 增大
增大
D. 加入MgCl2固体,HS-浓度减小
查看答案和解析>>
科目: 来源: 题型:
【题目】在下述转化关系中,已知B、D都是淡黄色固体,且A与D为单质,并可反应生成离子化合物。试回答:
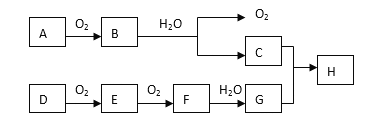
(1) G的化学式为________;
(2)写出B的电子式______________。
(3)写出B +水→C的化学反应方程式_______。
(4)B和E反应也可生成H,则该反应的化学方程式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka·Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变 。
A.①④ B.①②④ C.①②④⑤ D.①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,A、D同主族,B、C、D、E同周期,B、A可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,C是地壳中含量最高的金属元素。短周期中,B原子半径最大,E的最高价氧化物对应水化物酸性最强。
(1)E的最高价氧化物对应的水化物的分子式为________________;
(2)D与E可形成分子式为D2E2的物质,该物质为浅黄色油状液体,有特殊气味,是一种重要的工业添加剂。则D2E2的结构式为______________;
(3)B、C、D、E、A简单离子半径由大到小的顺序为_______________(用离子符号表示)
(4)用电子式表示化合物甲的形成过程________;
(5)C元素的单质能与B元素的最高价氧化物的水化物发生反应,写出该反应离子方程式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com