
科目: 来源: 题型:
【题目】氧化铅(PbO)是黄色固体。实验室用草酸在浓硫酸作用下分解制备CO,其原理为:H2C2O4![]() CO↑+CO2↑+H2O。某课题组同学设计实验探究CO还原氧化铅并检验氧化产物(已知CO能使银氨溶液产生黑色沉淀)的装置如图所示。下列说法正确的是
CO↑+CO2↑+H2O。某课题组同学设计实验探究CO还原氧化铅并检验氧化产物(已知CO能使银氨溶液产生黑色沉淀)的装置如图所示。下列说法正确的是

A. 实验时,先点燃装置①处酒精灯,当装置⑤中产生连续气泡且有明显现象后再点燃装置③处酒精灯
B. 实验完毕时,先熄灭装置①处酒精灯,再熄灭装置③处酒精灯
C. 装置②④⑤中的试剂依次为碱石灰、银氨溶液、澄清石灰水
D. 尾气处理可选用点燃、气袋收集、NaOH溶液吸收等方法
查看答案和解析>>
科目: 来源: 题型:
【题目】硅是无机非金属材料的主角,硅元素的单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用。试回答下列问题:
(1)硅在自然界中最主要的存在形式是_______和_______。
(2)有下列物体或设备:①水晶镜片 ②计算机芯片 ③玛瑙手镯 ④硅太阳能电池 ⑤石英光导纤维。(用序号填写)用到硅单质的是_________;所用材料主要为SiO2的是_________;
(3)写出工业上制取粗硅的化学反应方程式___________。其中,氧化剂为_____________,还原剂为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中,反应速率加快是由催化剂引起的是( )
A.在炭粉中加入KClO3,点燃时燃烧更为剧烈
B.H2O2中加入少量MnO2,即可迅速放出气体
C.将炭块粉碎成粉末状,可使燃烧更加充分
D.电解水时,加少量硫酸可使电解速率加快
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应 A(g) + 2B(g) ![]() 2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”、“减小”或“不变”)填入空格。
2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”、“减小”或“不变”)填入空格。
(1)升高温度,B的转化率_____________,v(正)____________,v(逆)____________。
(2)保持温度和压强不变,加入惰性气体,则C的物质的量_____________,A的转化率_____________。
(3) 保持温度和体积不变,加入惰性气体,A的转化率_____________。
(4)若温度和体积不变,反应从开始到平衡,容器内气体的密度_____________,压强____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题:
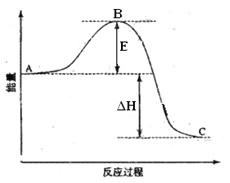
(1)图中A、C分别表示 、 ,
E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是
(2)图中△H= KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
、
;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1
,则υ(O2)= mol·L-1·min-1、
υ(SO3)= mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,求由S(s)生成3 molSO3(g)的△H= 。
查看答案和解析>>
科目: 来源: 题型:
【题目】硅单质及其化合物应用范围很广,请回答下列问题:
制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)写出由纯SiHCl3制备高纯硅的化学反应方程式___________;
(2)整个制备过程必须严格控制无水无氧,SiHCl3遇水剧烈反应生成H2SiO3,HCl和另一种物质,写出配平的化学反应方程式___________; H2还原SiHCl3过程中若混入O2,可能引起的后果是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
(1)根据下表中数据,在下图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:_________
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 1.00 | 0.00 |
1 | 0.90 | 0.80 | 0.20 |
3 | 0.75 | 0.50 | 0.50 |
5 | 0.65 | 0.30 | 0.70 |
9 | 0.55 | 0.10 | 0.90 |
10 | 0.55 | 0.10 | 0.90 |
14 | 0.55 | 0.10 | 0.90 |

(2)体系中发生反应的化学方程式是___________________________________________;
(3)列式计算该反应在0~3 min时间内产物Z的平均反应速率:_________________________;
(4)该反应达到平衡时反应物X的转化率α等于__________________________________________ ;
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是: 1___________________,2_______________________,3______________________。
1___________________,2_______________________,3______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)写出该反应的化学平衡常数表达式K=_____________________。降低温度,该反应K值____________,二氧化硫转化率____________,化学反应速率___________。(以上均填“增大”“减小”或“不变”)
(2)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是_______________________________________________。
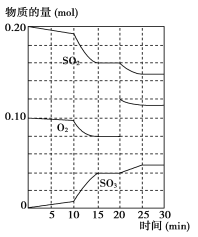
(3据上图判断,反应进行至20 min时,曲线发生变化的原因是_______________________(用文字表达);10 min到15 min的曲线变化的原因可能是__________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
(4)已知在600℃时,2SO2(g)+O2(g) ![]() 2SO3(g)的平衡常数K=19,若600℃时测得容器内c(SO2)=0.3mol/L,c(O2)=0.1mol/L,c(SO3)=0.4mol/L,在这种情况下,该反应是否处于平衡状态?_________(填“是”或“否”)。此时,化学反应速率是v(正)_______v(逆)(填“>”、“<”或“=”),原因是________________________________________________________________________________。
2SO3(g)的平衡常数K=19,若600℃时测得容器内c(SO2)=0.3mol/L,c(O2)=0.1mol/L,c(SO3)=0.4mol/L,在这种情况下,该反应是否处于平衡状态?_________(填“是”或“否”)。此时,化学反应速率是v(正)_______v(逆)(填“>”、“<”或“=”),原因是________________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g)![]() 2C(g) ΔH<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是
2C(g) ΔH<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是

A. 反应开始2 min内,v(B)=0.1 mol/(L·min)
B. t1时改变的条件可能是升高温度
C. t3时改变的条件可能是加压,此时c(B)不变
D. t4时可能是使用了催化剂,此时c(B)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com