
科目: 来源: 题型:
【题目】若NA表示阿伏加德罗常数的值,下列叙述中正确的是
A. 常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA
B. 22.4L N2与CO组成的混合气体所含有的电子数为14NA
C. 0.1mol/L K2CO3溶液中所含K+数目为0.2NA
D. 在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3molCl2转移的电子数为6NA
查看答案和解析>>
科目: 来源: 题型:
【题目】新装修的房屋会释放出有毒的甲醛气体。银-Ferrozine法检测甲醛(HCHO)的原理如下(在原电池中完成氧化银与甲醛的反应)。下列说法正确的是
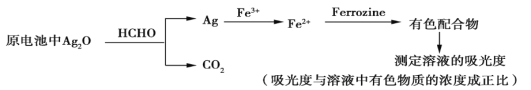
A. 其他条件相同,甲醛浓度越小,所得有色配合物溶液的吸光度越大
B. 电池正极的电极反应式为Ag2O+2H++2e-![]() 2Ag+H2O
2Ag+H2O
C. 30 g HCHO被氧化时,理论上电路中通过2 mol电子
D. 理论上,消耗HCHO和消耗Fe3+的物质的量之比为4∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】用二氧化碳可合成低密度聚乙烯(LDPE)。常温常压下以纳米二氧化钛膜为工作电极,电解CO2,可制得LDPE,该电极反应可能的机理如下图所示。下列说法正确的是
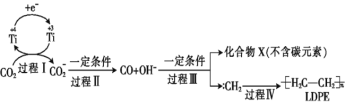
A. 含![]() 的-极与电源负极相连
的-极与电源负极相连
B. 过程Ⅰ、Ⅱ中碳元素均被还原,过程Ⅲ中碳元素被氧化
C. 电解过程中CO![]() 向阴极迁移
向阴极迁移
D. 工业上生产1.4×104 g的LDPE,转移电子的物质的量为6×103 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】城市地下潮湿的土壤中常埋有纵横交错的管道和输电线路,当有电流泄漏并与金属管道形成回路时,就会引起金属管道的腐蚀。原理如图所示,但若电压等条件适宜,钢铁管道也可能减缓腐蚀,此现象被称为“阳极保护”。下列有关说法不正确的是

A. 该装置能够将电能转化为化学能
B. 管道右端腐蚀比左端快,右端电极反应式为Fe-2e-![]() Fe2+
Fe2+
C. 如果没有外加电源,潮湿的土壤中的钢铁管道比较容易发生吸氧腐蚀
D. 钢铁“阳极保护”的实质是在阳极金属表面形成一层耐腐蚀的钝化膜
查看答案和解析>>
科目: 来源: 题型:
【题目】纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。
(1)工业上“侯氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理为:NaCl+NH3+CO2+H2O![]() NaHCO3↓+NH4Cl。生产纯碱的工艺流程示意图如下:
NaHCO3↓+NH4Cl。生产纯碱的工艺流程示意图如下:
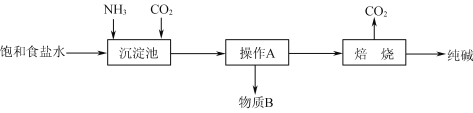
请回答下列问题:
①析出的NaHCO3晶体中可能含有少量氯离子杂质,检验该晶体中是否含有氯离子杂质的操作方法是_______________________________________________________________________。
②向沉淀池中先通入足量NH3,后通入CO2,析出NaHCO3晶体而不是Na2CO3晶体,其原因是_______________________________________________________________________。
③该工艺流程中可回收再利用的物质是________________。
④若制得的纯碱中只含有杂质NaCl。测定该纯碱的纯度,下列方案中可行的是________(填字母)。
a. 向m克纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g
b. 向m克纯碱样品中加入足量稀盐酸,用碱石灰(主要成分是CaO和NaOH)吸收产生的气体,碱石灰增重b g
c. 向m克纯碱样品中加入足量AgNO3溶液,产生的沉淀经过滤、洗涤、干燥,称其质量为b g
(2)常温下在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液20 mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液pH变化的部分情况如下图所示。
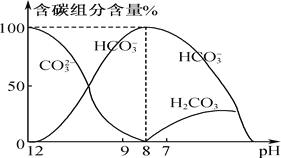
根据图示回答下列问题:
①在同一溶液中,CO32-、HCO3-、H2CO3________(填“能”或“不能”)大量共存。
②在滴加盐酸的过程中HCO3-的物质的量先增加后减少的原因是_____________、________(请分别用离子方程式表示)。
③将0.84 g NaHCO3和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.10 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是___________(填字母)。
A. 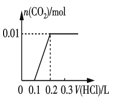 B.
B. 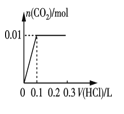
C. 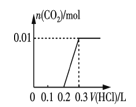 D.
D. 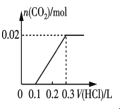
(3)若称取10.5 g纯净的NaHCO3固体,加热一段时间后,剩余固体的质量为8.02 g。如果把剩余的固体全部加入到100 mL 2 mol·L-1的盐酸中充分反应。求溶液中剩余的盐酸的物质的量浓度(设溶液的体积变化及盐酸的挥发忽略不计)(写出计算过程)。___________
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,P、M、N均是由这些元素组成的二元化合物,它们存在转化关系Q![]() P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是
P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是
A. 原子半径:Y>Z>W>X
B. 简单气态氢化物的热稳定性:Z>Y
C. Q既能与强酸溶液反应,又能与强碱溶液反应
D. Y的最高价氧化物对应的水化物与Q溶液混合,无M生成
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向1 L浓度为0.4 mol·L-1的乙醇酸[CH2(OH)COOH]溶液中加入8 g NaOH固体得到X溶液,将X溶液平均分成两等份,一份通入HCl气体,得到溶液Y,另一份加入NaOH固体得到溶液Z,溶液Y、Z的pH随所加物质的物质的量的变化情况如图所示(体积变化忽略不计)。下列说法正确的是

A. c点对应曲线代表的是加入NaOH的曲线
B. 溶液中水的电离程度:c>b
C. a点:c[CH2(OH)COO-]>c(Na+)>c(H+)>c(OH-)
D. 稀释Y溶液后,溶液中![]() 变大
变大
查看答案和解析>>
科目: 来源: 题型:
【题目】材料与化学密切相关,表中对应系错误的是w.w.w.k.s.5.u.c.o.m
材料 | 主要化学成分 | |
A | 刚玉、金刚石 | 三氧化二铝 |
B | 大理石、石灰石 | 碳酸钙 |
C | 普通水泥、普通玻璃 | 硅酸盐 |
D | 沙子、石英 | 二氧化硅 |
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,向一定体积0.1 mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH[pOH=-lg c(OH-)]与pH的变化关系如图所示,则( )

A. M点所示溶液的导电能力强于Q点
B. N点所示溶液中c(CH3COO-)>c(Na+)
C. Q点pH一定等于7
D. Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com