
科目: 来源: 题型:
【题目】某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极)。下列分析正确的是)

A. 电子流动方向为a→导线→b
B. H+经质子交换膜由右向左移动
C. 放电一段时间b极附近pH不变
D. a电极发生反应:H2N(CH2)2NH2+16e-+4H2O==2CO2↑+N2↑+16H+
查看答案和解析>>
科目: 来源: 题型:
【题目】离子键、共价键、金属键、范德华力是微粒之间的不同作用力,下列物质中含有上述任意两种作用力的是( )
①Na2O2 ②SiO2 ③氦气 ④金刚石 ⑤NH4Cl ⑥白磷
A.①②④B.①③⑥C.①⑤⑥D.③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
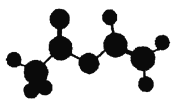
A. 该化合物的名称为乙酸乙酯
B. 该化合物与Br2的四氯化碳溶液不反应
C. 该化合物既能发生水解反应,又能发生氧化反应
D. 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组中的两种固态物质熔化(或升华)时,克服的微粒间相互作用力属于同种类型的是( )
A.碘和碘化钠B.金刚石和大理石
C.冰醋酸和硫磺D.干冰和二氧化硅
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中A~G均为中学化学中常见的物质,它们之间有如下转化关系。其中A是天然气的主要成分,B是一种能使带火星木条复燃的气体,C是一种能使澄清石灰石变浑浊的气体,E是一种淡黄色粉末状固体。(反应过程中某些产物已略去)
请回答问题:

(1)A的电子式为_______________________________。
(2)E的化学式为_______________________________。
(3)写出C转化为F的化学方程式_________________________________________。
(4)写出G溶液中通入过量C的离子方程式_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】天空不是垃圾场,污染气体不能随便排,研究大气污染气体的处理方法具有重要意义。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a kJ·mol-1 (a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b kJ·mol-1 (b>0)
若用标准状况下3.36LNO2氧化CO至CO2(NO2完全反应)的整个过程中放出的热量为_________ kJ(用含有a和b的代数式表示)。
(2) 已知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H=-870.3kJ/mo1
②C(s)+O2(g) =CO2(g) ΔH=-393.5kJ/mo1
③2C(s)+2H2(g)+O2(g) =CH3COOH(1) ΔH=-488.3kJ/mo1
请写出H2燃烧热的热化学方程式______________________________________。
(3)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如下图所示:

①NiO电极上发生的是_______________反应(填“氧化”或“还原”)。
②Pt电极上的电极反应式为_______________。
(4)一种新型催化剂能使NO和CO发生反应:2NO+2CO ![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
实验 编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.20×10-3 | B | 124 |
Ⅲ | 350 | A | 5.80×10-3 | 82 |
①请把表中数据补充完整:A_______________;B_______________。
②能验证温度对化学反应速率影响规律的是实验_______________(填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如下图所示,其中表示实验Ⅱ的是曲线_________(填“甲”或“乙”)。

查看答案和解析>>
科目: 来源: 题型:
【题目】请按要求完成下列各项填空:
(1)AlCl3的水溶液呈_______(填“酸”、“中”或“碱”)性,常温时的pH_____7(填“>”、“<”或“=”),原因是(用离子方程式表示):_________________________;实验室在配制 AlCl3溶液时,常将 AlCl3固体先溶于浓盐酸中,然后再用蒸馏水稀释到所需的浓度,以_________(填“促进”或“抑制”)其水解。将AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是________________(填化学式)。
(2)在纯碱溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是___________________________________________,其原因是(以离子方程式和简要的文字说明):_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】从废旧锂离子二次电池(主要成分为LiCoO2,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
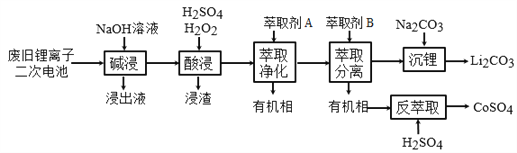
回答下列问题:
(1)“碱浸”的目的是_______。
(2)“酸浸”过程中LiCoO2发生反应的离子方程式为:___________________________
浸渣中含有的主要成分是________________。
(3)“萃取净化”除去的杂质离子有Ni2+外,还有_______。
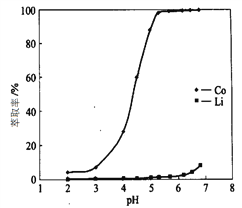
(4)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示, pH一般选择5左右,理由是________。
(5)“沉锂”中Li2CO3溶解度随温度变化曲线如下图所示:
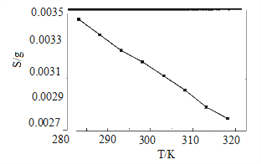
①根据平衡原理分析Li2CO3在水中溶解度随温度变化的原因_____________________。
②为获得高纯Li2CO3,提纯操作依次为趁热过滤、________、烘干。
③若“沉锂”中c(Li+)=1.0 mol·L1,加入等体积等浓度Na2CO3溶液,此时实验所得沉锂率为________。(已知Li2CO3的Ksp为9.0×10-4)
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组欲探究含硫物质的性质及制备。
(探究一)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
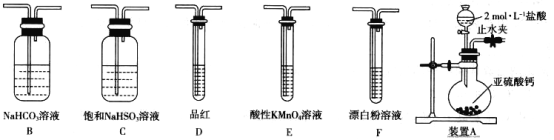
(1)装置A中盛固体的玻璃仪器名称是____________,装置A中反应的离子化学方程式为_______________________________。
(2)装置连接顺序为A、________________,其中装置C的作用是_________,通过现象___________________________,即可证明亚硫酸的酸性强于次氯酸。
(探究二)硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g/mol)可用作定影剂、还原剂。回答下列问题:
(3)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100mL_________中,再定容至凹液面与刻度线相平。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当_______________即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当_______________即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
(4)Na2S2O3常用于脱氯剂,在溶液中易被氯气氧化为SO42-,该反应的离子方程式为____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com