
科目: 来源: 题型:
【题目】对下列装置的叙述错误的是( )

A. X如果是硫酸铜,a和b分别连接直流电源正、负极,一段时间后铁片质量增加
B. X如果是氯化钠,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程
C. X如果是硫酸铁,则不论a和b是否用导线连接,铁片均发生氧化反应
D. X如果是氢氧化钠,将碳电极改为铝电极,a和b用导线连接,此时构成原电池铁作负极
查看答案和解析>>
科目: 来源: 题型:
【题目】有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为( )
A. ![]() mol/LB.
mol/LB. ![]() mol/LC.
mol/LC. ![]() mol/LD.
mol/LD. ![]() mol/L
mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】液氨作为一种潜在的清洁汽车燃料已越来越被重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。
(1)氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH2
则4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的ΔH=_____。(请用含有ΔH1、ΔH2的式子表示)
(2)氨气可以直接用于燃料电池,选择碱性溶液作为电解质溶液,写出负极的电极反应式__________。
(3)已知合成氨反应的方程式为N2+3H2![]() 2NH3,其平衡常数K的数值和温度的关系如下:
2NH3,其平衡常数K的数值和温度的关系如下:
温度/℃ | 200 | 300 | 400 |
K | 1.00 | 0.86 | 0.50 |
①由上表数据可知该反应ΔH______0(填“>”或“<”)。
②400℃时,测得某时刻c(N2)=1 mol·L-1、c(H2)=3 mol·L-1、c(NH3)=2 mol·L-1,此时刻该反应的v正____v逆(填“>”“=”或“<”)。
(4)下图是密闭反应器中按n(N2)∶n(H2)=1∶3投料后合成NH3,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

①曲线a对应的温度是__________________。
②关于合成氨的反应,下列叙述正确的是________。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 图中M、Q点平衡常数K的关系是K(M)>K(Q)
③M点对应的H2的转化率是____________________。
④400℃时,将1mol N2和3mol H2充入恒压密闭容器中,下图分别代表焓变(ΔH)、混合气体平均相对分子质量(M)、N2质量分数[φ(N2)]和混合气体密度(ρ)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是_____________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】液流式铅蓄电池以可溶性的甲基磺酸铅[(CH3SO3)2Pb]代替硫酸作为电解质溶液,该电池充放电的总反应为2Pb2++2H2O![]() Pb+PbO2+4H+,下列说法正确的是( )
Pb+PbO2+4H+,下列说法正确的是( )
A.该电池放电时,两极质量均增加
B.放电时,正极的电极反应式为PbO2+4H++2e-![]() Pb2++2H2O
Pb2++2H2O
C.充电时,溶液中Pb2+向阳极移动
D.充电时,阳极周围溶液的pH增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中不正确的是( )
A.欲实现铁片镀锌,用锌作阴极
B.电解精炼铜,若转移2mol电子,阴极质量增加64g
C.硫酸工业中采用沸腾炉以增加固、气接触面积,加快反应速率
D.工业上常用电解熔融氯化钠法制备金属钠
查看答案和解析>>
科目: 来源: 题型:
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )

A. 液滴中的Cl―由a区向b区迁移
B. 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH-
C. 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D. 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B是核电荷数为1~18中的元素,在自然界中含量A要多于B,它们的原子电子层结构均具有核外电子总数是电子层数的4倍的特点,回答下列问题:
(1)A、B的元素符号分别是 A______、B_______
(2)画出B离子结构示意图:_____
(3)由A和B元素组成的物质_____(填“属于”或“不属于”)电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:
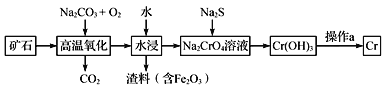
①Fe(CrO2)2中各元素化合价均为整数,则铬为_______价。
②高温氧化时反应的化学方程式为___________________________________。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式_______。
(3)铬元素能形成含氧酸及含氧酸盐,若测得初始浓度为1 mol·L-1的铬酸(H2CrO4)溶液中各种含铬元素的微粒浓度分别为:c(CrO42-)=0.0005 mol·L-1、c(HCrO4-)=0.1035 mol·L-1、c(Cr2O72-)=a mol·L-1、则a=______,KHCrO4溶液中c(OH-)______c(H+)(填“>”、“<”或“=”)。
(4)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。
①处理含有Cr2O72-的污水方法通常为:用铁作电极电解污水,Cr2O72-被阳极区生成的离子还原成为Cr3+,生成的Cr3+与阴极区生成的OH结合生成Cr(OH)3沉淀除去。则阴极上的电极反应式为________________________,若要处理含10 mol Cr2O72-的污水,则至少需要消耗的铁为_______g。
②转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含CrO42-的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出CrO42-在酸性条件下被Fe2+还原为Cr3+的离子方程式___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g) + I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知: (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com