
科目: 来源: 题型:
【题目】为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:

(1)该反应为____________(填“放热”或“吸热”)反应。
(2)A和B的总能量比C和D的总能量____________(填“高”或“低”)。
(3)物质中的化学能通过________转化成________释放出来。
(4)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)根据如图所示情况,判断下列说法中正确的是________。

A.其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.若当H2O为液态时反应热为ΔH2,则ΔH2>ΔH
(2)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是_________。
(3)已知反应:N2(g) + O2 (g) = 2NO(g) △H1
2H2(g) + O2(g) = 2H2O(g) △H2
N2(g) + 3H2(g) = 2NH3(g) △H3
利用上述三个反应,计算4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) △H4 的反应焓变为________________(用含△H1、△H2、△H3的式子表示)。
(4)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】目前人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。
4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 (填代号)。
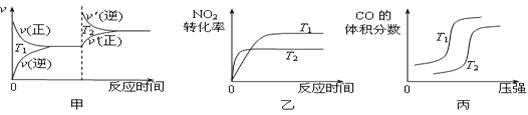
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s) + 2NO(g) ![]() N2(g) + CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g) + CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(CO
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 (填字母代号)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),ΔH 0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH= -l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式 。
(4)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。
电池反应为:4NH3+3O2=2N2+6H2O;
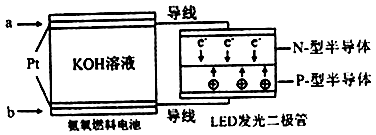
请写出通入a气体一极的电极反应式为 ;每消耗3.4g NH3转移电子的物质的量为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是—种极强的氧化剂,常应用于饮用水处理,其工业制备方法如图所示:

(1)高铁酸钾中铁元素的化合价是__________价。
(2)反应I的目的是________________________________。
(3)反应II的离子方程式为________________________________。
(4)洗涤粗品时选用乙醇而不用水的理由是________________________________。
(5)己知生成高铁酸钾的反应为Na2FeO4+2KOH![]() K2FeO4↓+2NaOH,请你解释加入饱和KOH溶液能生成高铁酸钾的理由是_________________________。
K2FeO4↓+2NaOH,请你解释加入饱和KOH溶液能生成高铁酸钾的理由是_________________________。
(6)为了提高生活用水的卫生标准,自来水厂常使用高铁酸钾(K2FeO4)进行消毒、净化以及改善水质,其消毒原理是______________________。
(7)可用亚铬酸盐滴定法测定高铁酸钾含量,滴定时有关反应的离子方程式为:
①FeO42-+CrO2-+2H2O==CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+=CrO72-+H2O
③CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
现称取2.084g高铁酸钾样品溶于适量NaOH溶液中,加入稍过量的NaCrO2,充分反应后过滤,滤液在250mL容量瓶中定容。每次取25.00mL加入稀硫酸酸化,用0.1000mol·L-1的FeSO4标准溶液滴定,三次滴定消耗标准溶液的平均体积为20.00mL。则上述样品中K2FeO4 的质量分数为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】把一定量的铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为
A.1∶1B.2∶1C.2∶3D.3∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:反应①Fe(s)+CO2(g)FeO(s)+CO(g);△H=Q1,平衡常数为K1,反应②Fe(s)+H2O(g)FeO(s)+H2(g);△H=Q2,平衡常数为K2,
在不同温度下,K1、K2的值如下:
T(K) | K1 | K2 |
700 | 1.47 | 2.38 |
900 | 2.15 | 1.67 |
(1)从上表可推断,反应Q1_____0(填“>”或“<”).
(2)现有反应③H2(g)+CO2(g)CO(g)+H2O(g);△H=Q3平衡常数为K3.根据反应①与②推导出K1、K2、K3的关系式K3=_____,Q1、Q2、Q3的关系式Q3=_____,可推断反应③是_____(填“放”或“吸”)热反应.
(3)要使反应③在一定条件下建立的平衡右移,可采取的措施有_____.
A.缩小容器体积 B.扩大容器的体积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(4)如图甲、乙表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
图甲中t2时刻改变的条件可能是_____,图乙中t2时刻改变的条件可能是_____.

查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )
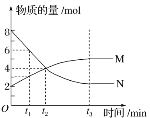
A. 化学方程式:2M![]() N
N
B. t2时,正逆反应速率相等,达到平衡
C. t3时,正反应速率大于逆反应速率
D. t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,可逆反应2AB+3C,在下列四种状态中,处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | vA=2 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
B | vA=2 mol·L-1·min-1 | vC=2 mol·L-1·min-1 |
C | vA=1 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
D | vA=1 mol·L-1·min-1 | vC=1.5 mol·L-1·min-1 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】已知密闭容器中进行的合成氨反应为N2+3H2![]() 2NH3,该反应为放热反应。下列判断正确的是( )
2NH3,该反应为放热反应。下列判断正确的是( )
A. 1 mol N2和3 mol H2的能量之和与2 mol NH3具有的能量相等
B. 反应过程中同时有1.5 mol H—H键、3 mol N—H键断裂时,N2的浓度维持不变
C. 降低NH3的浓度,正反应速率增大,逆反应速率减小
D. 当反应速率满足v(N2)∶v(H2)=1∶3时,反应达到最大限度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com