
科目: 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种粒子。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是

A. 反应后溶液的酸性明显增强
B. 消耗1 mol还原剂,转移6 mol电子
C. 该反应的还原剂是Cl-
D. 氧化剂与还原剂的物质的量之比为2∶3
查看答案和解析>>
科目: 来源: 题型:
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:

(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________________________。
(2)若改用60mL 0.25mol·L-1H2SO4和50mL 0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量___________(填“相等”、“不相等”),若实验操作均正确,则所求中和热__________填“相等”“不相等”)。
(3)倒入NaOH溶液的正确操作是:________。 (从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(4)使硫酸与NaOH溶液混合均匀的正确操作是:________。 (从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(5)实验数据如下表:①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ______ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=___________ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)_________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO![]() +H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)
+H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)
用4 mL 0.001 mol·L-1KMnO4溶液与2 mL 0.01 mol·L-1 H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如表所示:
组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
Ⅰ | 2 | 20 | |
Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
Ⅲ | 2 | 30 | |
Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为______________________。
(2)如果研究催化剂对化学反应速率的影响,使用实验____________和________(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验________和________。
(3)对比实验Ⅰ和Ⅳ,可以研究____________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
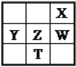
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应A(g)+2B(g)![]() 2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”“减小”或“不变”)填入空格。
2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”“减小”或“不变”)填入空格。
(1)升高温度,B的转化率________,v(正)________,v(逆)________。
(2)加正催化剂,A的物质的量____________,v(正)________,v(逆)________。
(3)保持温度和压强不变,加入稀有气体,则C的物质的量________,A的转化率________。
(4)保持温度和体积不变,加入稀有气体,A的转化率________。
(5)若温度和体积不变,反应从开始到平衡,容器内气体的密度________,压强________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现将0.4 mol A气体和0.2 mol B气体充入10 L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量的变化如图:

(1)若t1=10 min,则0至t1时间内C物质的平均反应速率为________;该反应在t1时达到平衡,其化学方程式为____________________________________。
(2)据图中曲线变化情况分析,t1时刻改变的反应条件可能是________。
A.加入了催化剂 B.降低了反应温度
C.向容器中充入了C D.缩小了容器体积
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,其中每个数字编号代表一种短周期元素。

请按要求回答下列问题:
(1)元素②的元素名称是_________;元素⑥的元素符号是___________。
(2)元素⑤处于周期表中第_____周期第______族。
(3)①~⑦七种元素中原子半径最大的是_________(填元素符号)。②③④三种元素的最简单氢化物中最稳定的是_________________(填化学式)。
(4)元素③和元素⑦的氢化物均极易溶于水,且二者能反应产生大量白烟,写出该反应的化学方程式______________。
(5)元素⑥的最高价氧化物对应的水化物是一种_____性氢氧化物,该物质与元素⑦的最高价氧化物对应水化物反应的离子方程式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化见下表:
2NO2(g)体系中,n(NO)随时间的变化见下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.02 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

(1)如图表示NO2的浓度变化的曲线是______________________。用O2表示从0~2 s内该反应的平均速率v=____________________。
(2)能说明该反应已达到平衡状态的是______________________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内密度保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温、恒压下,a mol A和b mol B在一个容积可变的容器中发生如下反应:A(g)+2B(g)![]() 2C(g),一段时间后达到平衡,生成n mol C,则下列说法中正确的是
2C(g),一段时间后达到平衡,生成n mol C,则下列说法中正确的是
A. 物质A、B的转化率之比为a∶b
B. 起始时刻和达到平衡后容器中的压强比为(a+b)∶![]()
C. 若起始时放入2a mol A和2b mol B,则达到平衡时生成2n mol C
D. 当v正(A)=2v逆(B)时,可确定反应达到平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com