
科目: 来源: 题型:
【题目】把2.3 g钠投入38.8 g水中,发生化学反应。假设水蒸发损失1 g,所得溶液中溶质的质量分数为( )
A. 4.6% B. 7.7% C. 10.0% D. 8.0%
查看答案和解析>>
科目: 来源: 题型:
【题目】24mL浓度为0.05mol·L-1的Na2SO3溶液,恰好与20mL浓度为0.02mol·L-1的K2Cr2O7,溶液完全反应,则元素Cr在被还原的产物中的化合价是(已知Na2SO3被氧化为Na2SO4)
A.+6B.+3C.+2D.0
查看答案和解析>>
科目: 来源: 题型:
【题目】超导材料为具有零电阻及磁性的物质,以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质YBa2Cu3Ox。现欲合成0.5 mol此高温超导物,依化学计量数比例需取Y2O3、BaCO3和CuO的物质的量分别为( )
A. 0.50 mol、0.50 mol、0.50 mol B. 0.25 mol、1.0 mol、1.5 mol
C. 0.50 mol、1.0 mol、1.5 mol D. 1.0 mol、0.25 mol、0.17 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】在进行化学实验时,经常会有与预期不符的现象出现。某化学实验小组在实验室进行铁盐与亚铁盐相互转化的实验,就出现了与预设不太一致的现象。
实验I:将Fe3+转化为Fe2+
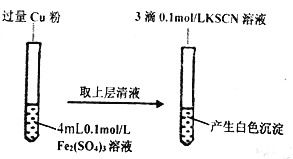
(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________。
(2)该小组同学用对比实验法探究白色沉淀产生的原因,请将其方案补充完整:
实验方案 | 现象 | 结论 |
步骤1:取4mL_________mol/ L CuSO4溶液,向其中滴加3滴0.1mo/ L KSCN溶液 | 产生白色沉淀 | Cu SO4与KSCN反应产生了白色沉淀 |
步骤2:取4mL0.2mol/ L FeSO4溶液,向其中滴加3滴0.1mol/ L KSCN溶液 | ___________ |
查阅资料:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
③(SCN)2的化学性质与I2相似
则Cu2+与SCN-反应的离子方程式为____________________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/L FeSO4溶液中加入lmL8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色) ②Fe(NO)2+与HNO3不反应
Fe(NO)2+(棕色) ②Fe(NO)2+与HNO3不反应
(3)用离子方程式解释NO产生的原因____________________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应I:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应I的速率比反应Ⅱ___________(填“快”或“慢”)。
②乙认为反应I是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是_______________________________________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因______________________。
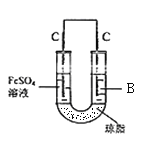
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,他利用实验室常用的仪器和药品设计并完成了如图所示的实验,实现了Fe2+![]() Fe3+的转化,同时避免出现此异常现象。实验发现:U形管右侧有气泡,U形管左侧的现象为___________、B溶液是___________溶液(填化学式)。
Fe3+的转化,同时避免出现此异常现象。实验发现:U形管右侧有气泡,U形管左侧的现象为___________、B溶液是___________溶液(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.小苏打溶液中加入烧碱溶液:![]()
B.氯化铝溶液中加入过量氨水:![]()
C.向氯化亚铁溶液中加入氯水:![]()
D.氢氧化钡溶液与稀硫酸混合Ba2++OH-+SO42-+H++OH-=BaSO4↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、量筒、泡沫塑料、泡沫塑料板、胶头滴管、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是______、_______________。他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5mol·L-1HCl溶液 | 20 ℃ | 23.3 ℃ | |
② | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
(2)NaOH用量比HCl用量稍多的原因是_________________________________。
(3)根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: ___________________。
(4)若用KOH代替NaOH,对测定结果________(填“有”或 “无”)影响;若用醋酸代替HCl做实验,对测定结果__________(填“有”或“无”)影响。
(5)两溶液混合后,怎样搅拌溶液_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应3A(g)+2B(g) ![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加B,B的平衡转化率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用0.1mol/L的醋酸溶液滴定10.00mL 0.1mol/L的MOH溶液,滴定过程中加入醋酸溶液的体积(V)与溶液中lg[c(H+)/c(OH-)]的关系如图所示(V=0时,lg[c(H+)c(OH-)]=-12)。下列说法不正确的是
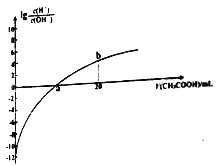
A. MOH是一元强碱
B. a 点:V(CH3COOH)=10.00mL
C. b R:c(M+)>(CH3COOH)>C(H+)>c(OH-)
D. 25℃时,CH3COO-的水解平衡常数约为5.9×10-10
查看答案和解析>>
科目: 来源: 题型:
【题目】双极膜电渗析一步法盐制酸碱的技术进入到了工业化阶段,某科研小组研究采用BMED膜堆(如图所示),模拟以精制浓海水为原料直接制备酸和碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜(A、D)已知:在直流电源的作用下,双极膜内中间界面层发生水的解离,生成H+和OH-。下列说法不正确的是
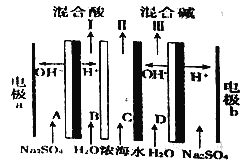
A. 电极b连接电源的负极 B. Ⅱ口排出的是淡水
C. 电解质溶液采用Na2SO4溶液可避免有害气体的产生 D. C为阴离子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com