
科目: 来源: 题型:
【题目】下图为A、B、C三种物质的溶解度曲线,请据图判断下列叙述中不正确的是

A. t1℃时,30gB物质溶解在50g水中形成80g溶液
B. t2℃时,不能配成溶质质量分数相同的三种物质的饱和溶液
C. 当A中混有少量C时,可采用冷却热饱和溶液法提纯A
D. A、C两种物质的饱和溶液从t2℃降到t1℃时,溶液的溶质质量分数相等
查看答案和解析>>
科目: 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。回答下列问题:
Ⅰ.CO可用于高炉炼铁,已知
Fe3O4(s)+4CO(g)====3Fe(s)+4CO2 △H1=akJ/mol
3Fe2O3(s)+ CO(g)====2Fe3O4(s)+CO2(g) △H2=bkJ/mol
则反应Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)的△H3=___________kJ/mol(用含a、b的代数式表示)
Ⅱ.光气(COCl2)在塑料、制革、制药等工业中有许多用途。工业上常利用废气CO2通过反应:C(s)+CO2(g)![]() 2CO(g) △H>0,制取合成光气的原料气CO。在体积可变的恒压(pa)密闭容器中充入1 mol CO2与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
2CO(g) △H>0,制取合成光气的原料气CO。在体积可变的恒压(pa)密闭容器中充入1 mol CO2与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
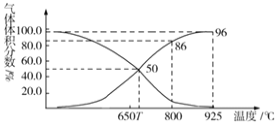
(1)①T℃时,在容器中若充入稀有气体,平衡___________移动(填“正向”“逆向”或“不”,下同);若充入等体积的CO2和CO,平衡___________移动。
②CO体积分数为80%时,CO2的转化率为___________。
③已知:气体分压(p分)=气体总压×体积分数。T℃时用平衡分压代替平衡浓度表示平衡常数Kp=___________(用含p总的代数式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g)![]() C6H5CH=CH2(g)+CO(g)+H2O(g)△H”中乙苯的平衡转化率影响如下图所示:
C6H5CH=CH2(g)+CO(g)+H2O(g)△H”中乙苯的平衡转化率影响如下图所示:
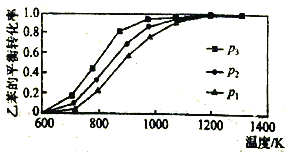
则△H___________0(填“>”“<”或“=”),压强p1、p2、p3从大到小的顺序是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
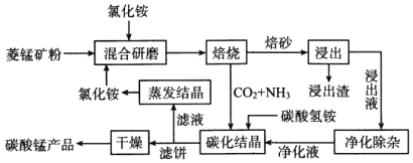
已知:①“焙烧”时发生的主要反应的化学方程式为MnCO3+2 NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O
MnCl2+2NH3↑+CO2↑+H2O
②菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
③相关金属离子[c(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
④常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。回答下列问题:
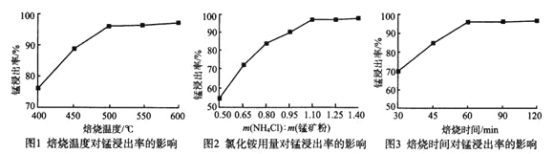
(1)分析下列图1、图2、图3,氯化铵焙烧菱锰矿的最佳条件是:___________。
(2)浸出液“净化除杂”过程如下:①加入MnO2。用离子方程式表示MnO2的作用___________;
②调节溶液的pH,除去Fe3+、Al3+。溶液恰当的pH范围为___________;
③加入NH4F将Ca2+、Mg2+除去,两种沉淀共存时溶液中c(Ca2+)=1×10-5mol·L-1,则c(Mg2+)=___________。
(3)碳化结晶过程中发生反应的离子方程式为______________________。
(4)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,可以得到重要的无机功能材料MnO2,该电极的电极反应式为______________________。
(5)25℃时,向0 .1mol/L NH3·H2O溶液中通入HC1气体,溶液中![]() 与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是___________。
与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是___________。

A.C点的溶液中:c(NH3·H2O)>c(NH4+)
B.NH3·H2O的Kb=1.0×10-4.7
C.pOH=3的溶液中:c(NH4+)+c(H+) +c(NH3·H2O)=0.1mol/L+c(OH-)
D.pOH=7的溶液中的溶质是NH4Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图象关系合理的是
A.  向pH=9的NaOH溶液中不断加水
向pH=9的NaOH溶液中不断加水
B.  在久置的NaOH溶液中加入盐酸
在久置的NaOH溶液中加入盐酸
C.  分别向稀盐酸中加入等质量的Fe和Mg
分别向稀盐酸中加入等质量的Fe和Mg
D.  在饱和的KNO3溶液中加入KNO3晶体
在饱和的KNO3溶液中加入KNO3晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验装置能达到实验目的的是

A. 用甲装置比较碳、氮和硅三种元素的非金属性强弱
B. 用乙装置分离碘的四氯化碳溶液
C. 用丙装置制取干燥的氨气
D. 用丁装置吸收氨气,并防止倒吸
查看答案和解析>>
科目: 来源: 题型:
【题目】下列四种粒子的结构示意图中,说法正确的是
① ②
② ③
③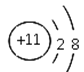 ④
④
A. 它们表示四种不同的元素B. ①④表示的是阳离子
C. ①③④表示的元素都是非金属元素D. ②表示的元素在化合物中通常显+2价
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。实验步骤如下:

①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液褪色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
(1)A试管中发生反应的化学方程式为__________。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是_____。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将实验后的溶液分成两份,分别滴加氯水和氨水,均产生白色沉淀。写出其中SO2表现还原性的离子反应方程式为_____。
(4)下列对导管E作用的分析中正确的是__________。
A 加热过程中,可上下移动导管E,起搅拌作用
B 停止加热,试管内的压强减少,从导管E进入的空气可增大试管A内的压强,防止倒吸
C 停止反应,撤装置之前往导管E中通入空气,可排出装置内的SO2气体,防止其污染环境
II ClO2与Cl2的氧化性相近,可用于自来水消毒和果蔬保鲜等方面。某兴趣小组通过图1装置(夹持装置略)对ClO2的制备、除杂、吸收和释放等进行了研究。

(1)仪器B的名称是________。打开B的活塞,A中发生反应为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加B中稀盐酸的速度宜______(填“快”或“慢”)。
(2)关闭B的活塞,ClO2在D中被某种稳定剂完全吸收生成NaClO2,此时F中溶液颜色不变,则装置C的作用是____。
(3)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_____;在ClO2释放实验中,打开E的活塞,D中发生反应,则此时装置F的作用是_____。安装F中导管时,应选用图2中的____(填“a”或“b”)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是

A. 4>2>1>3>5>6 B. 4>6>2>1>3>5 C. 5>4>2>3>1>6 D. 6>3>5>2>4>1
查看答案和解析>>
科目: 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(S)、液氯和三氧化硫为原料,在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为______________________。
(2)甲同学设计如图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2(夹持及加热装置略)
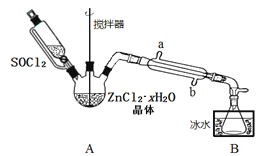
①SOCl2在该实验中的作用_________________________________;加热条件下,A装置中总的化学方程式为_________________________________。
②实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为___________(填序号)
a.干燥 b.洗涤; c加入足量硝酸酸化的硝酸银溶液,充分反应;
d称取蒸干后的固体m克溶于水;e.过滤; f称得固体为n克
若m/n=___________(保留小数点后两位),即可证明晶体已完全脱水。
(3)乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式_________________________________。
②丙同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加入足量SOCl2振荡使两种物质充分反应:
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、KSCN溶液、K3[Fe(CN)6]溶液、溴水)
方案 | 操作 | 现象 | 结论 |
方案一 | 往一支试管中滴加___________ | 若无明显现象 | 则发生了上述副反应 |
方案二 | 往另一支试管中滴加___________ | ___________ | 则没有发生上述副反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com