
科目: 来源: 题型:
【题目】I 充满HCl(标准状况)的烧瓶做完喷泉实验后得到的稀盐酸溶液,用标准氢氧化钠溶液滴定,以确定该稀盐酸的准确物质的量浓度。回答下列问题:
(1)该滴定实验盛装标准液的仪器是__________, 若该仪器的量程为50mL,调液面为0,将该仪器中所有液体放出,则放出的溶液体积_______50mL。(填“>”,“=”,“<”)
(2)若该滴定实验用酚酞做指示剂,达到滴定终点时,溶液颜色从____色变为____色且保持30s内不变色。
(3)配制三种不同浓度的标准氢氧化钠溶液,你认为最合适的是第______种。
①5.000 mol/L ②0. 5000 mol/L ③0.0500 mol/L
(4)若采用上述合适的标准氢氧化钠溶液滴定稀盐酸,操作步骤合理,滴定后的实验数据如下:
实验编号 | 待测盐酸的体积(mL) | 滴入氢氧化钠溶液的体积(mL) |
1 | 20.00 | 17.30 |
2 | 20.00 | 17.02 |
3 | 20.00 | 16.98 |
求测得的稀盐酸的物质的量浓度为_________________________。
II 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式______________。
(2)判断滴定终点的方法是______。
(3)计算:血液中含钙离子的浓度为____g·mL-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)现有pH=3的HCl溶液100 mL,要使它的pH=4,如果加入蒸馏水,需加水_____ mL (假定溶液体积有加和性,下同)。
(2)常温下,将pH=8的NaOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH=_______。
(3)今有A.盐酸 B.醋酸 C.硫酸三种酸:
①在同体积、同浓度的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是______________.(填写酸的序号并用符号“>、<、=”连接,下同)
②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系是__________,反应所用时间长短关系是_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】250C时,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图7 所示。下列有关溶液中离子浓度关系的叙述正确的是

A. pH="5." 5 的溶液中: c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B. W 点所表示的溶液中: c(Na+)+c(H+)= c(CH3COOH)+c(OH-)
C. pH =" 3." 5 的溶液中: c(Na+) +c(H+) -c(OH-) +c(CH3COOH)=0.1mol·L-1
D. 向W 点所表示的1.0L 溶液中通入0.05mol HCl 气体(溶液体积变化可忽略): c(H+)= c(CH3COOH)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。下列说法错误的是
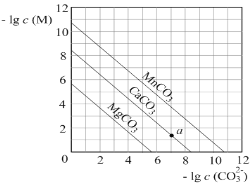
A. Ksp(MnCO3)的数量级为10-11
B. MgCO3的悬浊液中加入少量水充分振荡,c(Mg2+)不变
C. a点表示的溶液中,c(Ca2+)>c(CO32-)
D. 向浓度均为0.01mol·L-1的Mg2+、Ca2+、Mn2+混合溶液中逐滴加入Na2CO3溶液,最先形成MgCO3沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。回答下列问题:
(1)据媒体报道,挪威和荷兰正在开发一种新能源盐能。当海水和淡水混合时,温度将升高0.1℃,世界所有入海口的这种能源相当于电力需求的20%。海水和淡水混合时,温度升高最可能的原因是______。
A.发生了盐分解反应
B.发生了水分解反应
C.由于浓度差产生放热
D.盐的溶解度增大
(2)蒸馏法是人类最早使用的淡化海水的方法。你认为蒸馏法淡化海水最理想的能源是_______。
(3)从海水中可得到多种化工原料和产品,如图是利用海水资源的流程图。

①反应Ⅱ的离子方程式为_________。
②从反应Ⅲ后的溶液中得到纯净的单质溴的实验操作方法是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,错误的是( )
A. 元素周期表中有7个主族、7个副族B. 稀有气体元素原子的最外层电子数均为8个
C. 碳元素位于第2周期IVA族D. 氢分子中的化学键是共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子中,在溶液中能大量共存的是( )
A. CO32-、S2-、NO3-、Ca2+B. Al3+、Na+、S2-、SO42-
C. Al3+、NH4+、K+、SO42-D. Fe2+、Ca2+、H+、NO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时在10 mL 0.1mol·L—1Na2CO3溶液中逐滴加入0.1 mol·L—1HCl溶液20 mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法正确的是( )

A. 0.1 mol·L—1Na2CO3溶液中c(Na+)+c(H+)=c(OH—)+c(CO32—)+c(HCO3—)
B. 当加入10mL盐酸时,所得混合溶液pH>7
C. 当pH=8时,c(Na+)=c(CO32—)+c(HCO3—)+c(H2CO3)
D. 在M点:c(CO32—)=c(HCO3—)>c(Na+)>c(OH—)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向10mL H2A溶液中滴加0.1mol/L NaOH溶液.有关微粒的物质的量变化如图.根据图示判断,下列说法不正确的是

A. H2A是二元弱酸
B. 当0 mL<V(NaOH)<20 mL时,一定有:c(OH﹣)+c(HA﹣)+2c(A2﹣)=c(Na+)+c(H+)
C. 当V(NaOH)=10 mL时,溶液中离子浓度关系一定有:c(Na+)>c(HA﹣)>c(H+)>c(A2﹣)>c(OH﹣)
D. 当V(NaOH)=20 mL后,再向溶液中加水稀释,c(H+)减小,c(OH﹣)也减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com