
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)同温同压下,同体积的甲烷(CH4)和二氧化碳原子总数之比为_____,密度之比为_____。
(2)在标准状况下,CO和CO2的混合气体共39.2L,质量为61g,则其中CO2为____ mol。
(3)9.03×1023个NH3含___mol氢原子,在标准状况下的体积为____L。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ:用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。
(2)如果按图中所示的装置进行试验,求得的中和热数值_______(填“偏大、偏小、无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与(2)中实验相比,所求中和热_________ (填“相等”或“不相等”)。
Ⅱ: (1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6),丙烷脱氢可得丙烯。已知:C3H8(g) === CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6 kJ·mol-1
CH3CH=CH2(g)=== CH4(g)+ HC≡CH(g ) △H2=+32.4 kJ·mol-1
则C3H8(g) === CH3CH=CH2(g)+H2(g) △H =______________ kJ·mol-1。
(2)发射火箭时用肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知32gN2H4(g)完全发生上述反应放出568kJ的热量,热化学方程式是:____________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质间发生的化学反应属于吸热反应的是( )
A. 木炭和氧气B. 生石灰和水C. 盐酸和氢氧化钠溶液D. NH4Cl晶体和Ba(OH)28H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
①标准状况下,11.2 L以任意比例混合的氮气和氧气所含的原子数为NA
②同温同压下,体积相同的氢气和氩气所含的分子数相等
③标准状况下,22.4 L H2O中分子数为NA
④32 g O2和O3混合气体中含有原子数为2NA
A.①②③④B.①②④C.①③④D.②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2<T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率等于b点
D. 图4表示同一温度下,相同物质的量BaO2在不同容积的容器中进行反应:2BaO2(s)![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下,现有![]() ;
;![]() 个HCl分子;
个HCl分子;![]() ;
;![]()
![]() ,对这四种气体的关系有以下四种表述:其中正确的是 ______ .
,对这四种气体的关系有以下四种表述:其中正确的是 ______ .
a.体积:![]()
b.物质的量:![]()
c.质量:![]()
d.氢原子个数:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学反应2A![]() B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验 | 时 间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热)。理由是
查看答案和解析>>
科目: 来源: 题型:
【题目】以粉煤灰(主要成分为Al2O3、SiO2,还含少量Fe2O3等)为原料制取氧化铝的部分工艺流程如下:
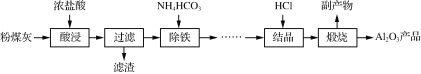
(1)“酸浸”过程发生的主要反应的离子方程式是_______________________________________________。
“酸浸”在恒容密闭反应釜中进行,温度不宜过高的原因是________________________________________________________________________。
(2)“除铁”生成Fe(OH)3的离子方程式为_________________,检验溶液中铁元素已经除尽的方法是________________________________________________________________________。
(3)“结晶”是向浓溶液中通入HCl气体,从而获得AlCl3·6H2O晶体的过程,溶液中Al3+和盐酸的浓度随通气时间的变化如下图所示。Al3+浓度减小的原因是_________________________。

(4)上述流程中,可以循环利用的物质是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,甲、乙、丙、丁四个烧杯中分别盛有100mL蒸馏水,然后分别放入等物质的量的Na、Na2O、Na2O2、NaOH,待固体完全溶解,则四个烧杯中溶液的质量分数的大小顺序为( )
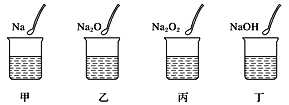
A.甲<乙<丙<丁B.丁<甲<乙=丙C.甲=丁<乙=丙D.丁<甲<乙<丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com