
科目: 来源: 题型:
【题目】Ⅰ、化学实验是化学学习的重要内容,根据你掌握的知识,完成下面内容。实验室需要配制0.1mol·L-1 NaOH溶液230mL,请回答下列问题:
(1)用天平称取______ g NaOH。配制过程中所需玻璃仪器除了胶头滴管和烧杯,还有_____、______ 。
(2)溶解NaOH后的溶液需冷却到室温后方能转移。若趁热转移会使溶液的浓度 _____(填“偏大”、或“偏小”,下同)
(3)有人认为,用这种方法只能配制0.1mol· L-1 的NaOH溶液,而无法得到0.1000mol· L-1 的NaOH溶液,你觉得他的理由是____________ 。
Ⅱ.氯气是一种重要的化工原料,自来水消毒、农药生产、药物合成都需要它。

(1)工业上通常采用电解法制氯气,请观察图1后回答下列问题:
通电后,b侧产生的气体用湿润的淀粉碘化钾试纸检验,现象是变蓝。化学方程式_____
(2)某学生设计如图2所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:
①在A装置中制取氯气,请写出反应的化学方程式 ____________。
②漂白粉在U形管中产生,其化学方程式是 ____________。
③装置C的作用是__________。
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应发生,可采取的措施是_______。
②试判断另一个副反应(用化学方程式表示)________,为避免此副反应的发生,可以在A与B之间连接一个装有_______ 的洗气瓶。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:25℃时,Ksp[Zn(OH)2]= 1.0×10-18,Ka(HCOOH)=1.0×10-4。该温度下,下列说法错误的是
A. HCOO-的水解常数为1.0×10-10。
B. Zn(OH)2溶于水形成的饱和溶液中,c(Zn2+)>1.0×10-6mol·L-1
C. 向Zn(OH)2悬浊液中加入HCOOH,溶液中c(Zn2+)增大
D. Zn(OH)2(s)+2HCOOH(aq)![]() Zn2+(aq) +2HCOO-(aq)+2H2O(1)的平衡常数K=100
Zn2+(aq) +2HCOO-(aq)+2H2O(1)的平衡常数K=100
查看答案和解析>>
科目: 来源: 题型:
【题目】(加试题 )M结构简式如图所示,是牙科粘合剂,X是高分子金属离子螯合剂,以下是两种物质的合成路线:


已知:I.A为烯烃,C属于环氧类物质,G分子中只有1种氢原子
II.
III.
IV.R1CHO+R2NH2![]() R1CH=NH2+H2O
R1CH=NH2+H2O
(1)A→B的反应类型是_________,C→D的可采用的反应条件是____________。
(2)下列说法正确的是______。
A.B中含有的官能团是碳碳双键和氯原子
B.J可与Na2CO3溶液反应,1 mol J与饱和溴水反应最多消耗4mol Br2
C.在一定条件下,F可以发生缩聚反应
D.X可发生加成、氧化和消去反应
(3)Q+Y→X的化学方程式是_________________________________________。
(4)请设计以甲苯和A作为原料制备 的合成路线流程图(无机试剂任用)____________________________。
的合成路线流程图(无机试剂任用)____________________________。
(5)写出符合下列条件的K的同分异构体:____________________________
①能发生银镜反应,不能发生水解反应;
②含有五元碳环,核磁共振氢谱有5组峰;
③结构中无-C=C-OH和-O-O-
查看答案和解析>>
科目: 来源: 题型:
【题目】一种突破传统电池设计理念的镁-锑液态金属储能电池的工作原理如图所示,该电池所用液体密度不同,在重力作用下分三层,工作时中间层熔融盐的组成及浓度不变。下列说法不正确的是( )

A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为Mg2++2e-=Mg
C. 该电池充电时,Mg-Sb(液)层发生还原反应
D. 该电池充电时,Cl-向中下层界面处移动
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列变化一定加入还原剂才能实现的是______________(填序号)
①Fe2+→Fe ②CO2→HCO3-③ MnO4-→Mn2+ ④SO2→SO3 ⑤KMnO4→MnO2 ⑥ HCl→Cl2 ⑦SO32-→SO2 ⑧NH4+→NH3
(2)我国古代四大发明之一的黑火药是由硫粉、硝酸钾和木炭按一定比例混合而成,爆炸时的反应为S+ 2KNO3 +3C = K2S + N2↑ + 3CO2↑,反应中被还原的物质是 ___________(填化学式)
(3)NaH可在野外作生氢剂,反应原理为NaH + H2O = NaOH + H2↑,该反应中氧化产物和还原产物的质量比为____________ 。
(4)2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl2 +5Cl2↑ + 8H2O,用单线桥标出电子转移的方向和数目__________;HCl表现出的性质是 ___________________。
(5)取300mL 0.2mol· L-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量是 _________mol。
(6)为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是______________ (用含w1和w2的式子表示)。
(7)取50mL含Na2CO3和Na2SO4的混合溶液与过量盐酸反应,生成2.24L CO2(标准状况),然后加入足量的Ba(OH)2溶液,得到的沉淀的质量为2.33g。试计算原混合溶液中Na+的物质的量浓度______ mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学购买了一瓶“84消毒液”,包装说明如下,下列分析不正确的是( )

A.“84消毒液”保存时不能敞口放置,需要密封保存
B.该“84消毒液”中NaClO的物质的量浓度约为4mol·L-1
C.取100mL该“84消毒液”稀释100倍后用以消毒,稀释后的溶液中c(Na+)约为0.04mol·L-1
D.欲用NaClO固体配制含25% NaClO的消毒液480mL,需要称量的NaClO固体质量为142.8g
查看答案和解析>>
科目: 来源: 题型:
【题目】(加试题)NH4Al(SO4)2·12H2O(铵明矾)可用作泡沫灭火器的内留剂、石油脱色剂等。某兴趣小组同学用氧化铁、铝粉、镁条和氯酸钾等物质做铝热反应后的铝灰及硫酸铵等为原料制备铵明矾的实验,步骤如下:
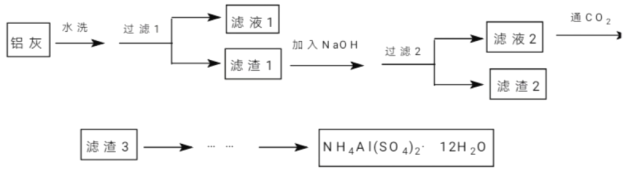
(1)下列有关说法中正确的是_________。
A.“滤液1”中含有K+、Mg2+、Cl-
B.“滤渣1”和“滤渣2”中含有相同的物质
C.“过滤1”可用倾析法,以缩减实验时间
D.将“滤液3”蒸干并灼烧,可得纯碱
(2)用NaOH溶解“滤渣1”时,可以采用_________的方式提高浸出率(写出3条)。
(3)向“滤液2”中通入足量的CO2,写出相应的离子反应方程式__________________。
(4)由“滤渣3”制备铵明矾,经过如下步骤:a→g→_________→h(依次填入正确的序号)
a.加硫酸溶解 b.抽滤
c.加入蒸发皿中
d.降温结晶
e.蒸发至表面出现晶膜
f.配制饱和硫酸铵溶液
g.将硫酸铝溶液转移至蒸发皿
h.洗涤、干燥
(5)①根据各物质的溶解度曲线(见下图),在80℃时,用一定浓度的硫酸溶解“滤渣3”时,最适宜的硫酸浓度为_________。

A.3mol/L(1.20g/mL)
B.6mol/L(1.34g/mL)
C.9mol/L(1.49 g/mL)
D.18mol/L (1.84g/mL)
②所需硫酸用量的简便确定方法是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】镍钴锰三元材料是近年来开发的一类新型锂离子电池正极材料,具有容量高、循环稳定性好、成本适中等重要优点。镍钴锰三元材料中Ni为主要活泼元素,通常可以表示为:LiNiaCobMncO2,其中a+b+c=1,可简写为LiAO2。充电时总反应为LiAO2 + nC = Li1-xAO2 + LixCn(0<x<1),工作原理如下图所示,则以下说法正确的是( )

A. 放电时Ni元素最先失去电子
B. 放电时电子从a电极由导线移向b电极
C. 充电时的阳极反应式为LiAO2 - xe-= Li1-xAO2 + xLi+
D. 充电时转移1mol电子,理论上阴极材料质量增加7g
查看答案和解析>>
科目: 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.3 molMnO2和100mL 12 mol/L的浓盐酸混合后缓慢加热,充分反应后向留下的溶液中加入足量的AgNO3溶液,生成AgCl沉淀的物质的量为(不考虑HCl的挥发)( )
A. 等于0.6molB. 小于0.6mol
C. 大于0.6mol,小于1.2molD. 以上结论都不正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com