
科目: 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可用作分析试剂、基准试剂、还原剂、除氯剂等。
Ⅰ、实验室制备硫代硫酸钠装置图如下。

(1)仪器B的名称是________。
(2)写出装置B制备Na2S2O3的化学反应方程式____________________________。
(3)NaOH溶液的作用是____________________________________。
Ⅱ、测硫代硫酸钠样品纯度步骤如下
①称取Ⅰ中制得硫代硫酸钠样品8.0g配成250mL溶液
②从①中量取20.00mL溶液于锥形瓶中
③用0.lmol·L-1标准碘液滴定,实验测得数据如下
滴定前读数(mL) | 滴定后读数(mL) | 待测液体积(mL) | |
实验一 | 1.20 | 21.00 | 20.00 |
实验二 | 0.40 | 19.20 | 20.00 |
实验三 | 0.50 | x | 20.00 |
(4)该滴定时,向锥形瓶中加入1至2滴淀粉液作指示剂,则达到滴定终点的判断标准是______________。
(5)x读数如图所示,则x=________,根据所测的数据计算该硫代硫酸钠样品纯度为_______________。(已知I2+2Na2S2O3=2NaI+Na2S4O6)

(6)若步骤①中量取20.00mL硫代硫酸钠溶液时,未用硫代硫酸钠溶液润洗滴定管,则测得样品的纯度将______________(填“偏大”或“偏小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温条件下,分别将SO2通入100mL(NH4)2SO3溶液、100mLNaOH溶液中,测得溶液pH与各组分物质的量分数的变化关系如图和如图,已知Kb(NH3·H2O)=1.8×10-5,下列说法不正确的是( )

图1:SO2通入(NH4)2SO3溶液中

图2:SO2通入NaOH溶液中
A. b点n(NH4+):n(HSO3-)=3:1
B. 由图1可得Ka1(H2SO3)=10-2,Ka2(H2SO3)=10-7
C. 图2中,b点溶液呈中性
D. 由图2可得NaOH溶液的浓度为10mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 光照新制的氯水时,溶液的pH逐渐减小
B. 加催化剂,使N2和H2在一定条件下转化为NH3
C. 含有Fe3+、Cu2+的溶液中加入CuO使Fe3+产生Fe(OH)3沉淀
D. 增大压强,有利于SO2与O2反应生成SO3
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生铁块,放置一段时间。下列有关描述错误的是( )

A. 生铁块中的碳是原电池的正极
B. 红墨水柱两边的液面变为左低右高
C. 两试管中相同的电极反应式是:Fe →Fe2++2e-
D. a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】(11分)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为________,该元素的符号是________。
(2)Y元素原子的价层电子的电子排布图为________,该元素的名称是________。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________。
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________________________________________________________。
(5)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由
_________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】原子结构模型的演变图如右,下列符合历史演变顺序的一组排列是

A. (1)(3)(2)(4) B. (1)(2)(3)(4)
C. (1)(4)(3)(2) D. (1)(3)(4)(2)
查看答案和解析>>
科目: 来源: 题型:
【题目】氮和氮的相关化合物在很多领域有着广泛的应用。请回答:
I.搭载“神舟十一号”的长征-2F火箭使用的推进剂燃料由N、H两种元素组成,且原子个数N:H=1:2,其水溶液显碱性。
(1)该物质中N原子的杂化方式为________,溶于水呈碱性的原因为___________(用离子方程式表示)。
(2)氮元素的第一电离能比相邻的氧元素大,其原因为________________。
II.笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。
(3)预测N2O的结构式为________________。
(4)在短周期元素组成的物质中,写出与NO2-互为等电子体的分子_________。(写两个,填分子式)
III.氮化钛为金黄色晶体,有仿金效果,越来越多地成为黄金的代替品。
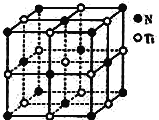
(5)Ti金属晶体的堆积模型为________,配位数为_______,基态Ti3+中未成对电子数有______个。
(6)氮化钛晶体的晶胞与NaCl晶胞相似(如图所示),该氮化钛的密度为ρg·cm-3,则该晶胞中N、Ti之间的最近距离为______nm(NA为阿伏加德罗常数的值,只列计算式)。该晶体中与氮原子距离相等且最近的钛原子围成的空间几何体为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:

4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是__.
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.

①写出基态Cu原子的核外电子排布式__;金属铜采用下列__(填字母代号)堆积方式.

②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)__.
③水分子间存在氢键,请你列举两点事实说明氢键对水的性质的影响__.
④SO42﹣的空间构型是________.
查看答案和解析>>
科目: 来源: 题型:
【题目】据报道,科研人员应用计算机模拟出结构类似C60的物质N60,已知N60分子中每个氮原子均以N—N键结合三个N原子而形成8电子稳定结构。已知N—N键键能为159 kJ·mol-1,试回答下列问题:
(1)根据上述信息推测N60的结构特点:________________。
(2)1 mol N60分解成N2时吸收或放出的热量是____kJ。(已知N≡N的键能为946 kJ·mol-1)
(3)由(2)列举N60的一些用途:______________________________________。
(4)若N60分子中只含x个五边形和y个六边形,则x=________,y=____________。(已知:多面体中,棱边数=顶点数+面数-2)
(5)∠NNN=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是_______。

(2)H2Se的酸性比H2S________ (填“强”或“弱”)。气态SeO3分子的立体构型为________,SO32-离子的立体构型为________。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角________120°(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com