
科目: 来源: 题型:
【题目】如图装置可以达到实验目的的是

选项 | 实验目的 | X中试剂 | Y中试剂 |
A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Na2SO3与浓盐酸制取并收集纯净干燥的SO2 | 饱和Na2SO3溶液 | 浓硫酸 |
C | 用Zn和稀盐酸制取并收集纯净干燥的H2 | NaOH溶液 | 浓硫酸 |
D | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】苯甲酸是一种重要的化工原料。实验室合成苯甲酸的原理及装置示意图(加热、 夹持及辅助仪器省略)和一些相关信息如下:
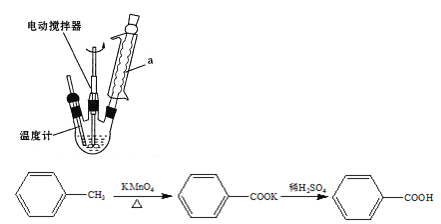
名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | ﹣95 | 110.6 | 0.8669 | 不溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 112.4(100℃左右升华) | 248 | 1.2659 | 微溶 | 易溶 |
苯甲酸在水中的溶解度如表:
温度/℃ | 4 | 18 | 75 |
溶解度/g | 0.2 | 0.3 | 2.2 |
某学习小组在实验室制备、分离、提纯苯甲酸,并测定所得样品的纯度,步骤如下:
Ⅰ.在b 中加入 2.7 mL 甲苯、100 mL水和几片碎瓷片,开动电动搅拌器,a中通水。将b 中的液体加热至沸腾,分批加入 8.5 g 高锰酸钾,继续搅拌约5 h,停止加热和搅拌,静置。
Ⅱ.在反应混合物中加入一定量草酸(H2C2O4)充分反应,过滤、洗涤,将滤液放在冰水浴中冷却,再用浓盐酸酸化,苯甲酸全部析出后减压过滤,冷水洗涤,干燥,得到粗产品。
Ⅲ.称取m g产品,配成 100 mL乙醇溶液,移取25.00 mL溶液于锥形瓶,滴加2~3滴酚酞,然后用标准浓度KOH溶液滴定。请回答下列问题:
(1)装置a的作用___________
(2)分离提纯过程中加入的草酸是一种二元弱酸,反应过程中有酸式盐和无色气体生成。加入草酸的作用_______,请用离子方式表示该反应原理_____。
(3)产品减压过滤时用冷水洗涤的原因是_____________
(4)选用下列________(选填字母)操作,可以将粗产品进一步提纯。
A 溶于水后过滤 B 溶于乙醇后蒸馏
C 用甲苯萃取后分液 D 升华
(5)测定纯度步骤中,滴定终点溶液的颜色变化是__。若m=1.200 g,滴定时用去0.1200 mol·L-1 标准KOH溶液20.00 mL,则所得产品中苯甲酸的质量分数为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将1.000 mol/L盐酸滴入20.00 mL 1.000 mo1/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是( )

A. a点由水电离出的c(H+) = 1.0 × 10-14 mo1/L
B. b点:c(NH4+) > c(Cl-) > c(OH-) > c(H+)
C. c点:盐酸与氨水恰好完全反应
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目: 来源: 题型:
【题目】前20号元素W、X、Y、Z的原子序数依次增大,且分列四个不同周期和四个不同主族。其中A为Y元素组成的单质;甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物;常温下乙为液体。下列说法正确的是

A. 简单离子半径:Z>Y
B. 反应①为吸热反应
C. 反应②为工业上制备漂白粉的反应原理
D. X、Y分别与Z形成的化合物中,化学键类型一定相同
查看答案和解析>>
科目: 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是

A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(a+2b) kJ·mol-1
CuCl(s)的ΔH=(a+2b) kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1000 mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是( )

A. A、B两酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 若a小于5,则A、B都是弱酸,且A的酸性弱于B
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如装置简图:

请你参与分析讨论:
(1)图中仪器B的名称:____________________。
(2)整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_____________。
(3)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:_________________________________________________。
(4)C中液体产物颜色为___________________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行分离的操作是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了配制NH4+与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入( )
①适量的HC1 ②适量的NH4NO3 ③适量的氨水 ④适量的NaOH
A. ①② B. ②③ C. ③④ D. ①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。

请回答下列问题:
(1)写出A的结构简式__________,B、D分子中的官能团名称分别是__________、__________。
(2)写出下列反应的化学方程式,并注明反应类型:
②____________________,____________________;
④____________________,____________________。
(3)在实验室利用B和D制备E的实验中,若用1mol B和1 mol D充分反应,能否生成1mol E__________,原因是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究反应:![]() 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A. 使用催化剂 B. 适当提高氧气的浓度
C. 适当提高反应的温度 D. 适当降低反应的温度
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
(3)从断键和成键的角度分析上述反应中能量的变化。
(资料)①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能。
②化学键的键能:
化学键 | H—H | O=O | H—O |
键能 | 436 | 496 | 463 |
请填写表:
化学键 | 填“吸收热量”或“放出热量” | 能量变化 | |
拆开化学键 |
| ______ | ____ |
| ______ | ____ | |
形成化学键 |
| ______ | ____ |
总能量变化 | ______ | ____ | |
(4)氢氧燃料电池的总反应方程式为![]() 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是__________________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是__________________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com