
科目: 来源: 题型:
【题目】完成下列化学方程式,并标明反应类型.
(1)CH4+Cl2![]() _____,_____;(只写产物均为气体的一个)
_____,_____;(只写产物均为气体的一个)
(2)CH2=CH2+Br2→__________,____________;
(3)![]() +Br2
+Br2![]() _________,_____。
_________,_____。
(4)与乙烯和氢气的加成产物互为同系物的是_____(填写编号)。
a C2H2 b C6H6 c C5H12 d C2H6O
(5)请写出乙烯加聚反应方程式_________
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,将铁、铜通过导线相连,置于硫酸铜溶液中:

(1)铜片上的现象是_____,电极反应为_____。
(2)电子由_____经导线流向_____。
(3)若反应过程中有 0.2 mol 电子发生转移,则生成的铜的质量为_________ 。
(4)高铁电池的总反应为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时,负极的电极反应式是_________。正极附近溶液的碱性_________(填“增强”、“不变” 或“减弱”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)硫化氢是一种有剧毒的气体,它的电子式为____________。
(2)最近我国科学家设计了一种![]() 协同转化装置,可以实现对天然气中
协同转化装置,可以实现对天然气中![]() 和
和![]() 的高效去除。示意图如所示,其中电极分别为
的高效去除。示意图如所示,其中电极分别为![]() 石墨烯(石墨烯包裹的
石墨烯(石墨烯包裹的![]() )和石墨烯,石墨烯电极区发生反应为:
)和石墨烯,石墨烯电极区发生反应为:
a、![]()
b、![]()

①光伏电池所用材料为____________(选填字母)
a. 碳化硅 b. 硅单质 c. 二氧化硅 d. 四氟化硅
②该装置的能量转化形式为_______能转化为______能再转化为______能。
③![]() 石墨烯为______(选填“正极”、“负极”、“阳极”或“阴极”),所发生的电极反应方程式为__________________________________。
石墨烯为______(选填“正极”、“负极”、“阳极”或“阴极”),所发生的电极反应方程式为__________________________________。
(3)硫化氢在工农业生产中也有一定的用途。![]() 和
和![]() 混合加热可以制得羰基硫
混合加热可以制得羰基硫![]() 。羰基硫可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在
。羰基硫可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在![]() 和
和![]() 温度下,在恒容密闭容器中,将一定量
温度下,在恒容密闭容器中,将一定量![]() 和
和![]() 混合加热并达到下列平衡:
混合加热并达到下列平衡:![]() 。根据图中信息,请回答问题:
。根据图中信息,请回答问题:
①![]() ________
________![]() ,该反应正向_________(选填“吸热”或“放热”或“无法判断”)。
,该反应正向_________(选填“吸热”或“放热”或“无法判断”)。
②反应前![]() 投料为_________
投料为_________![]() 。(已知
。(已知![]() 温度下,该反应平衡常数为
温度下,该反应平衡常数为![]() )。
)。
③![]() 温度下在
温度下在![]() 时刻保持其他条件不变将容器体积扩大为原来的
时刻保持其他条件不变将容器体积扩大为原来的![]() 倍,请补全
倍,请补全![]() 到
到![]() (已达平衡)时间段内的图线_________。
(已达平衡)时间段内的图线_________。
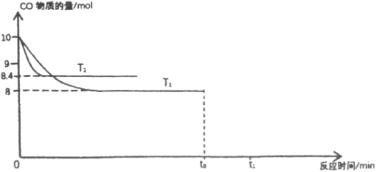
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 时,向
时,向![]() 溶液中滴加等浓度的
溶液中滴加等浓度的![]() 溶液,溶液的
溶液,溶液的![]() 与
与![]() 溶液的体积关系如图所示。下列叙述正确的是( )
溶液的体积关系如图所示。下列叙述正确的是( )

A. ![]() 溶液中水的电离程度比
溶液中水的电离程度比![]() 溶液中大
溶液中大
B. ![]() 点溶液中含有
点溶液中含有![]() 和
和![]()
C. ![]() 点,
点,![]()
D. ![]() 点,
点,![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.
A元素原子的核外p电子数比s电子数少3 |
B元素形成的物质种类繁多.其形成的一种固体单质工业上常用作切割工具 |
C元素基态原子p轨道有3个未成对电子 |
D原子核外所有p轨道全满或半满 |
E在该周期中未成对电子数最多 |
F能形成红色(或砖红色)和黑色的两种氧化物 |
某同学根据上述信息,推断
(1)画出A基态原子的核外电子排布图____________________。
(2)B基态原子的核外电子排布图![]() , 该同学所画的电子排布图违背了____________________________________。
, 该同学所画的电子排布图违背了____________________________________。
(3)D基态原子中能量最高的电子,其电子云在空间有____________个方向,原子轨道呈____________形。
(4)写出C原子的电子排布式 ____________;写出E原子的电子简化排布式____________。
(5)请写出F元素价电子排布式________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以下实验方案合理的是( )
实验目的 | 实验设计 | |
A | 鉴别乙醇和二甲醚 | 分别取少量样品用元素分析仪进行测定 |
B | 用高锰酸钾溶液滴定未知浓度的乙二酸溶液 | 用待装液体分别润洗酸式和碱式滴定管再进行操作 |
C | 确定某无色溶液中含有 | 取少量待测液加 |
D | 鉴别 | 分别滴加氨水至过量,观察现象 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2H2S(g)+O2(g)=S2(s)+2H2O(1) ΔH =-632 kJ·mol-1。下图为H2S燃料电池的示意图。下列说法正确的是

A. 电极a为电池的负极
B. 电极b上发生的电极反应为:O2+2H2O+4e-=4OH-
C. 每有10mol氧气参加反应,电池内部吸收632 kJ热能
D. 每34gH2S参与反应,电路中有2mol电子通过
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A. ![]() 在
在![]() 中燃烧可以生成
中燃烧可以生成![]() 和
和![]() 的混合物
的混合物
B. 在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
C. 相同温度下,![]() 在同浓度的
在同浓度的![]() 和
和![]() 溶液中的溶解度不相同
溶液中的溶解度不相同
D. 电解精炼铜时,同一时间内阴极析出铜的质量比阳极溶解铜的质量小
查看答案和解析>>
科目: 来源: 题型:
【题目】在某温度下,反应![]()
![]() ,能量变化如图所示,实验研究小组在
,能量变化如图所示,实验研究小组在![]() 恒容密闭容器中加入
恒容密闭容器中加入![]() 、
、![]() 气体,经测定反应
气体,经测定反应![]() 分钟达到平衡,放出能量
分钟达到平衡,放出能量![]() 。下列说法中,正确的是( )
。下列说法中,正确的是( )

A. 过程Ⅱ可能使用了催化剂,催化剂可以提高![]() 的平衡转化率
的平衡转化率
B. 反应物断键吸收能量之和小于生成物成成键释放能量之和
C. 上述实验中![]() 的转化率为
的转化率为![]()
D. 上述实验从开始到平衡的平均速率![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在 2 L 恒容密闭容器中 3 种物质间进行反应,X、Y、Z 的物质的量随时间的变化曲线如图所示,反应在 t1 min 时达到平衡。

(1)请写出该反应的化学方程式:_____。
(2)若上述反应中X、Y、Z 分别为 NH3、H2、N2,在此 t1 min 时间内,用H2 表示该反应的平均速率 v(H2)为_____。
(3)拆开 1mol 共价键所需吸收的能量如下表:
共价键 | H-H | N≡N | N-H |
吸收的能量/kJ | 436 | 946 | 391 |
1mol N2 完全反应为NH3_____(填:吸收或放出)_____kJ 能量。事实上,将 1molN2 和3molH2 放在反应容器中,使它们充分反应,反应的热量变化总小于计算值,原因是_________。
(4)下列叙述能判断该反应达到平衡状态的是_____(填字母代号)。
A 容器内各气体组分的质量分数不再发生改变
B 正反应速率与逆反应速率相等
C 容器内气体的密度不再发生改变
D 混合气体的平均相对分子质量不再发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com