
科目: 来源: 题型:
【题目】用下列实验方案不能达到实验目的的是( )

A. 图A装置——Cu和稀硝酸制取NOB. 图B装置——检验乙炔的还原性
C. 图C装置——实验室制取溴苯D. 图D装置——实验室分离CO和CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2]。下列有关说法正确的是( )
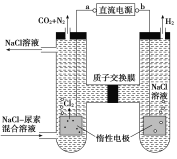
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 除去尿素的反应为:CO(NH2)2+2Cl2+H2O== N2+CO2+4HCl
D. 若两极共收集到气体0.6mol,则除去的尿素为0.12mol(忽略气体溶解,假设氯气全部参与反应)
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D是中学化学中常见的四种物质,且A、B、C中含有同一种元素,其转化关系如图所示。下列说法正确的是( )
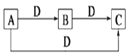
A. 若B为一种两性氢氧化物,则D可能是强酸,也可能是强碱
B. 若A为固态非金属单质,D为O2,则A可以为单质硫
C. 若A为强碱,D为CO2,则B的溶解度一定大于C的溶解度
D. 若A为18电子气态氢化物,D为O2,则A只能是C2H6
查看答案和解析>>
科目: 来源: 题型:
【题目】下列装置能达到实验目的的是
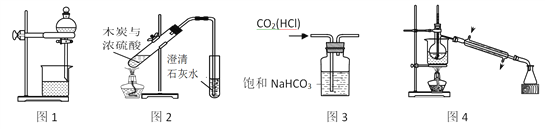
A. 图1用于分离酒精和水
B. 图2用于验证木炭与浓硫酸的反应产物中含有CO2
C. 图3用于除去CO2中的少量HCl
D. 图4用于制备蒸馏水
查看答案和解析>>
科目: 来源: 题型:
【题目】A,B,C,D四种短周期元素的原子半径依次减小,D能分别与A,B,C形成电子总数相等的分子X、Y、Z。C原子的最外层电子排布为nsnnp2n。E的原子序数为29。
(1)A,B,C的第一电离能由小到大的顺序为________(用元素符号表示)。
(2)X是含有________键(填“非极性”或“极性”,下同)的________分子。
(3)A的一种氢化物的相对分子质量为26,其分子中的σ键与π键的键数之比为________。
(4)Y分子的空间构型为__________,其中心原子采取________杂化。
(5)一种由B,C组成的化合物与AC2互为等电子体,其化学式为________。
(6)Y是一种易液化的气体,请简述其易液化的原因_________。
(7)写出E2+的电子排布式___________________,并写出E2+在Z中通入足量Y得到深蓝色溶液的离子反应方程式_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1molCH4和0.1molCl2充分反应,生成的C-Cl键和H-Cl键的数目均为0.2NA
B. 7.8gNa2S和Na2O2的混合物中所含阴离子的数目等于0.2NA
C. 18g固态水(冰)中含有的氢键的数目为2NA
D. 25℃时,Ksp(AgI)=1.0×10-16,则AgI饱和溶液中Ag+数目为1.0×10-8NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组模拟工业上从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的工艺流程如下:(已知溶液D中通入过量的CO2得到白色沉淀)

请回答下列问题:
(1)操作Ⅰ的名称为________。
(2)不溶物A是_________________(填化学式),写出A与氢氧化钠溶液反应的离子方程式_________________________________。
(3)+3价的铝常或多或少地置换硅酸盐中+4价的硅而形成铝硅酸盐。已知某种铝硅酸盐主要成分的化学式为Al2Si2O5(OH)4,请将其改写成氧化物的组合形式________。
(4)溶液D中Al元素的主要存在形式为_____________(填离子符号)
(5)写出E→G的化学方程式____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫和氮及其化合物在生产生活中应用广泛。请回答:
(1)将SO2通入品红溶液中,现象为品红溶液________,加热后溶液颜色________。
(2)已知反应:SO2+Cl2+2H2O ═ 2HCl+H2SO4,该反应中的氧化产物是__________。
(3)木炭与浓硫酸共热的化学反应方程式为:C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,则转移电子的物质的量是_________mol。
CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,则转移电子的物质的量是_________mol。
(4)工业上可以通过氮气和氢气在一定条件下合成氨气。下列关于氨气的性质和用途描述正确的是____________。
A.氨气易液化,液氨可作制冷剂 B.可用排水法收集氨气
C.氨气是一种无色无味的气体 D.向氨水中滴加酚酞,溶液变红
(5)实验室检验试管里氨气是否收集满的方法是___________________(写出一种即可)。
(6)汽车尾气常含有NO、NO2、CO等,会污染空气。在汽车尾气排放管处安装一个催化转化器,可使尾气中有害气体CO和NO反应转化为两种无毒气体,该反应的化学方程式为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某工业废水中含有CN-和Cr2O![]() 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
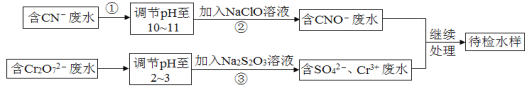
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为_______。
(2)步骤③的反应为![]() (未配平),则每反应0.1molCr2O72-时,消耗S2O32-_____mol。
(未配平),则每反应0.1molCr2O72-时,消耗S2O32-_____mol。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是______。
(4)在25℃下,将![]() 的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a____0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=____。
的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a____0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=____。
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程式是_______;________。
查看答案和解析>>
科目: 来源: 题型:
【题目】水的硬度常用一种规定的标准来衡量:将水中的Ca2+、Mg2+都看作Ca2+,并将其质量折算成CaO的质量,通常把1L水中含有10mgCaO称为1°,1L水中含有20mgCaO即为2°,以此类推,8°以上为硬水,8°以下为软水,Ca2+、Mg2+的硬度之和称为总硬度。用配位滴定法分析某水样(含有Ca2+、Mg2+、Fe3+、Cl-、SO42-、HCO3-)的硬度时,取50.00mL水样放入250mL锥形瓶中,加入稀盐酸数滴,煮沸,冷却,加入2mL1∶1的三乙醇胺溶液和10mLNH3·H2O—NH4Cl缓冲溶液(pH=10)及3滴酸性铬蓝K素酚绿B混合指示剂,用0.01000mol·L-1 EDTA溶液滴定至由红色到蓝色即终点,消耗EDTA溶液12.5mL。另取水样50.00mL,将上述操作中加入缓冲溶液改为加入20%的NaOH溶液使pH>12,用0.01000mol·L-1 EDTA溶液滴定至终点,消耗EDTA溶液7.50mL。(已知Ca2+、Mg2+、Fe3+与EDTA反应的化学计量比均为1∶1)
(1)日常生活中可用____检验某水样是硬水还是软水。
(2)加入数滴稀盐酸并煮沸的目的是______。
(3)加入三乙醇胺溶液的目的是_____。
(4)试计算水样钙硬度和水样总硬度(写出计算过程)。_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com