
科目: 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成:

下列说法不正确的是
A. Y的分子式为C10H8O3
B. 由X制取Y的过程中可得到乙醇
C. 一定条件下,Y能发生加聚反应和缩聚反应
D. 等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为3∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析能得出的结论是( )
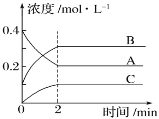
A.发生的反应可表示为2B(g)+C(g) ![]() 2A(g)
2A(g)
B.开始时,正、逆反应同时开始
C.前2 min A的分解速率为0.1mol·L-1·min-1
D.2 min时,A、B、C的浓度之比为2∶3∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法正确的是
A.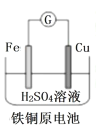 Fe 棒为负极,电极反应为 Fe-3e-= Fe3+
Fe 棒为负极,电极反应为 Fe-3e-= Fe3+
B.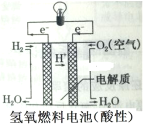 能够给用电器提供电势差,是由于两个电极上有得失电子能力不同的氢气和氧气
能够给用电器提供电势差,是由于两个电极上有得失电子能力不同的氢气和氧气
C. 锌筒作负极,发生还原反应,锌筒会变薄
锌筒作负极,发生还原反应,锌筒会变薄
D.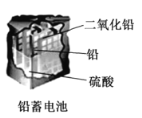 使用一段时间后硫酸铅沉淀在电极板上,溶液酸性减弱,导电能力下降
使用一段时间后硫酸铅沉淀在电极板上,溶液酸性减弱,导电能力下降
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO等大气污染物处理对建设美丽中国具有重要意义。
(1)已知: ①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol 下列物质分解为气态基态原子消耗能量(即分子的总键能)分别为:
CO2+NO该反应的平衡常数为K1(下同),每1mol 下列物质分解为气态基态原子消耗能量(即分子的总键能)分别为:
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) △H=+ 179.5 kJ /mol K2
2NO(g) △H=+ 179.5 kJ /mol K2
③2NO(g) + O2(g) ![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
试写出NO与CO反应生成无污染的N2和CO2的热化学方程式_______________________以及此热化学方程式的平衡常数K=________(用K1、 K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时CO的平均反应速率v(CO)=_____。
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时CO的平均反应速率v(CO)=_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图。则下列说法不正确的是( )
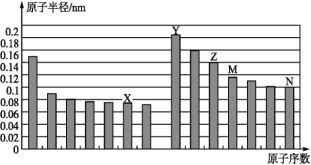
A.Z、N两种元素的离子半径相比,后者较大
B.X、N两种元素的气态氢化物的稳定性相比,前者较强
C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z的氢氧化物能分别溶解于Y的氢氧化物的水溶液和N的氢化物的水溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】化学能可与热能、电能等相互转化。下列说法正确的是( )
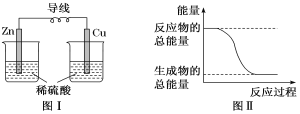
A.图Ⅰ所示的装置能将化学能转化为电能
B.中和反应中,反应物的总能量比生成物的总能量低
C.化学反应中能量变化的主要原因是化学键的断裂与形成
D.图Ⅱ所示的反应为吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
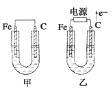
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的____________棒,乙池中的____________棒。
②乙池中阳极的电极反应式是___________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式_________________ 。
②甲池中碳极上电极反应式是_____________________,
③若乙池转移0.02 mol e-后停止实验,溶液体积是200 mL,则溶液混合均匀后的pH=____。
查看答案和解析>>
科目: 来源: 题型:
【题目】柠檬烯是一种食用香料,其结构简式如图所示。下列有关柠檬烯的说法不正确的是( )
![]()
A. 它的核磁共振氢谱有8组吸收峰
B. 它的分子中所有的碳原子不可能在同一平面上
C. 它和丁基苯(![]() )互为同分异构体
)互为同分异构体
D. 一定条件下,它可以发生加成、取代、氧化等反应
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物I(分子式为C19H20O4)属于芳香酯类物质,是一种调香剂,其合成路线如下:
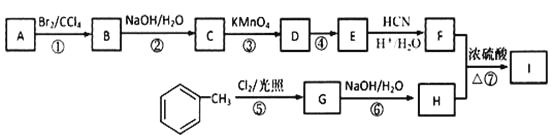
已知:①A 属于脂肪烃,核磁共振氢谱显示有 2 组峰,面积比为 3:1,其蒸气密度是相同条件下 H2 的 28 倍;D 分子式为C4H8O3;E 分子式为 C4H6O2,能使溴水褪色。
②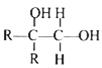
![]()
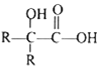 其中 R 为烃基。
其中 R 为烃基。
③![]()
![]()
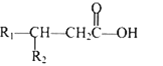 其中 R1 和 R2 均为烃基。
其中 R1 和 R2 均为烃基。
回答下列问题:
(1)A 的结构简式为_______。
(2)D 中官能团的名称是_______。
(3)反应②化学方程式为_______。
(4)E的同系物K 比E 多一个碳原子,K有多种链状同分异构体,其中能发生银镜反应且能水解的有_______种。
(5)反应①~⑦属于取代反应的是_______ (填序号)。
(6)反应⑦的化学方程式为_______。
(7)参照上述合成路线,以![]() 原料(无机试剂任选),经 4 步反应制备可降解塑料
原料(无机试剂任选),经 4 步反应制备可降解塑料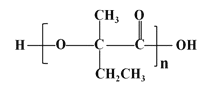 _______ (例如合成流程CH3CH2Br
_______ (例如合成流程CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3)
CH3COOCH2CH3)
查看答案和解析>>
科目: 来源: 题型:
【题目】1942 年,我国化工专家侯德榜以 NaCl、NH3、CO2 等为原料先制得 NaHCO3,进而生产出纯碱, 他的“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3 ;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl ;
2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,请写出工业合成氨的化学反应方程式_______
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是_______。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。
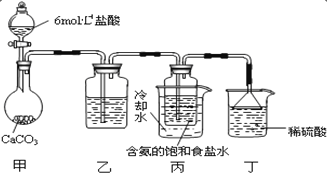
请回答:
①写出甲中发生反应的离子方程式_______。
②乙装置中的试剂是_______。
③实验结束后,分离出 NaHCO3 晶体的操作是_______ (填分离操作的名称)。
第二位同学:用如图装置进行实验(其它装置未画出)。
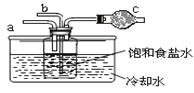
①为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从 a 管通入_______气体,再从b 管中通入_______气体。
②装置 c 中的试剂为_______(选填字母)。
e.碱石灰 f..浓硫酸 g.无水氯化钙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com