
科目: 来源: 题型:
【题目】废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为________________。
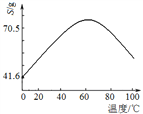
②温度与Fe2+、Mn2+氧化程度之间的关系如图1所示:

图1
实验过程中应将温度控制在________________。Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为________________。
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是________________。
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图2所示。A包含物质的化学式为N2和________________。


图2 图3
(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图3所示。
①吸收初期(图中A点以前)反应的化学方程式为________________。
②C点高于B点的原因是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将2.7g铝溶解于100mL 3 mol·L-1 NaOH溶液中,然后向所得溶液中加入400mL 1 mol·L-1盐酸,最后可得沉淀的质量是()
A.2.7gB.5.2gC.7.8gD.10g
查看答案和解析>>
科目: 来源: 题型:
【题目】利用锌冶炼废渣(ZnSO4、CuSO4、FeSO4、FeS2、Al2O3、SiO2)制备ZnSO4和Fe2O3的实验流程如下:

已知:“碱浸”时,NaOH溶液浓度越大越粘稠,越容易生成铝硅酸钠沉淀。
(1) “水浸”阶段需在70~80℃条件下进行,适宜的加热方式为________________。
(2)“氧化”阶段是将Fe2+氧化后进一步生成Fe(OH)3,从反应产物的角度分析,以氯水替代H2O2的缺点是①使ZnSO4中混有ZnCl2;②________________。
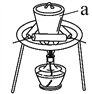
(3)“灼烧”时FeS2发生反应的化学方程式为________________。使用的装置如右图,仪器a的名称为________________。
(4) “碱浸”阶段,在其它条件不变的情况下,所得固体中Fe2O3含量随NaOH溶液的浓度的增大而增大,但当氢氧化钠浓度大于12 mol·L-1时,Fe2O3含量反而降低,其原因是________________。
(5)“滤液Ⅰ”溶质主要是ZnSO4和CuSO4。已知硫酸锌晶体的溶解度随温度变化如右图,请设计从“滤液Ⅰ”中获取ZnSO4晶体的实验方案:________________(实验中须使用的试剂有:Zn粉、稀H2SO4、酒精)。
查看答案和解析>>
科目: 来源: 题型:
【题目】白钠镁矾(mNa2SO4·nMgSO4·xH2O)俗称硝板,工业上用白钠镁矾制备碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]晶须的过程如下:向碳酸钠溶液中加入白钠镁矾,保持50℃加热0.5h,有大量的5MgCO3·3H2O生成,然后升高温度到85℃加热2h发生热解反应,过滤得碱式碳酸镁晶体。
(1)热解反应的方程式为________________。
(2)碱式碳酸镁可用作化学冷却剂,原因是________________。
(3)为测定白钠镁矾的组成,进行下列实验:
①取白钠镁矾3.340 g溶于水配成100.00 mL溶液A;
②取25.00 mL溶液A,加入足量的氯化钡溶液,得BaSO4 1.165 g;
③另取25.00 mL溶液A,调节pH=10,用浓度为0.1000 mol·L-1的EDTA标准溶液滴定Mg2+(离子方程式为Mg2+ + H2Y2-=MgY2-+ 2H+),滴定至终点,消耗标准溶液25.00 mL。通过计算确定白钠镁矾的化学式(写出计算过程)。___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物H是一种用于合成药物的中间体,其合成路线流程图如下:

(1)B中的含氧官能团名称为羟基、________________和________________。
(2)B→C的反应类型为________________。
(3)写出同时满足下列条件的A的一种同分异构体的结构简式:________________。
①含有苯环,且遇FeCl3溶液不显色;
②能发生水解反应,水解产物之一能发生银镜反应,另一水解产物分子中只有3种不同化学环境的氢。
(4)F 的分子式为C18H20O4,写出F的结构简式:________________。
(5)以苯、甲醛和丙酮为基础有机原料,制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。___________________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】H2S为二元弱酸。20 ℃时,向0.100 mol·L-1的Na2S溶液中缓慢通入HCl气体(忽略溶液体积的变化及H2S的挥发)。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
A. 通入HCl气体之前: c(S2-)>c(HS-)>c(OH-)>c(H+)
B. c(HS-)=c(S2-)的碱性溶液中: c(Cl-)+c(HS-)>0.100 mol·L-1+c(H2S)
C. pH=7的溶液中: c(Cl-)=c(HS-)+2c(H2S)
D. c(Cl-)=0.100 mol·L-1的溶液中: c(OH-)-c(H+)=c(H2S)-c(S2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,把下列各题的结果填在横线上。
(1)c(OH-)=1×10-3mol/L的溶液的pH=___________________
(2)0.01mol/L HNO3溶液中,水电离出的H+的物质的量的浓度c(H+)=_________________
(3)某溶液由水电离出H+的物质的量的浓度c(H+)= 1×10-5mol/L,则该溶液可以是______(填“硫酸”或“氯化铵”或 “氢氧化钠” 或“氯化钠”)溶液
(4)将0.39g过氧化钠溶于足量水中并配成100 mL溶液,则溶液的pH=_____________
(5)0. 12mol/L HCl溶液与0.1mol/L 的NaOH溶液等体积混合,混合液的pH=___________
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol·L-1的标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“ 0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2-3次;
请回答下列问题:
(1)以上步骤有错误的是(填编号)_____________,该错误操作会导致测定结果_________ (填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00mL待测液应使用________________ (填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果____________(填“大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视_______________________;判断到达滴定终点的依据是_______。
(4)以下是实验数据记录表
滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 18.10 |
2 | 20.00 | 0.00 | 16.30 |
3 | 20.00 | 0.00 | 16.22 |
从上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是(______)
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视读数
(5)根据上表记录数据,通过计算可得,该盐酸浓度为____________mol·L-1

(6)室温下,用0.100mol/L NaOH溶液分别滴定20.00mL0.100mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是(______)
A.Ⅱ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗V(NaOH)小于20mL
C.V(NaOH) =20mL时,c( Cl- )=c(CH3COO- )
D.V(NaOH) =10mL时,醋酸溶液中:c( Na+ )> c(CH3COO-)> c( H+ )> c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】利用所学化学反应原理,解决以下问题:
(1)KAl(SO4)2·12H2O可做净水剂,其原理是____________________________________(用离子方程式表示)
(2)碳酸氢钠溶液蒸干并灼烧得到的固体物质是__________(填化学式)
(3)向FeCl3溶液中滴加NaHCO3溶液,有沉淀和气体生成的离子方程式_____________
(4)将AgCl分别放入①5mLH2O ②10mL0.2mol·L-1MgCl2溶液 ③20mL0.5mol·L-1NaCl溶液④40mL0.1mol·L-1HCl溶液中溶解至饱和,各溶液中Ag+的浓度由大到小的顺序是________________________(用序号填空)
(5)常温下amol/LCH3COOH稀溶液和bmol/LKOH稀溶液等体积混合:若c(K+)<c(CH3COO-),则a_____________b(填>、<、=),室温下,1mol/L相同体积的下列四种溶液:①KCl②FeCl3③HF④Na2CO3中,所含阳离子数由少到多的顺序是_________________________(用序号填空)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com