
科目: 来源: 题型:
【题目】如图为由石油制取汽油的装置示意图,根据图示回答下列问题。

(1)图中的两处明显的错误是________________、__________________
(2)A仪器的名称是________,B仪器的名称是________。
(3)实验时 A 中除加入石油外,还需加入少量__________,其作用是__________________。
(4)收集完汽油后,是先撤酒精灯还是先停冷凝水?
______________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA为强酸
B. 该混合液pH=7
C. 图中X表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=0.1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示的四种实验操作名称从左到右依次是( )

A.过滤、蒸发、蒸馏、分液B.过滤、蒸馏、蒸发、分液
C.蒸发、蒸馏、过滤、分液D.分液、蒸馏、蒸发、过滤
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值,下列说法正确的( )
A. 常温常压下,22.4L的O2含有分子数为NA
B. 标准状况下,22.4L的SO3含有分子数为NA
C. 标准状况下,17gNH3含有的电子数为8 NA
D. 常温常压下,14gC2H4和C3H6的混合物含原子数为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】关于如图中四个图像的说法正确的是


注:图中,E表示能量,p表示压强,t表示时间,V表示体积。
A. ①表示化学反应H2(g)+Cl2(g)===2HCl(g)的能量变化,则该反应的反应热ΔH=+183 kJ/mol
B. ②表示其他条件不变时,反应4A(g)+3B(g)![]() 2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是气体
2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是气体
C. ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液
D. ④表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.通常状况下,NA个CO2分子占有的体积约为22.4L
B.1mol·L-1Na2SO4溶液中所含Na+的数目为2NA
C.40gNaOH溶解在1L水中,则其100mL溶液中含Na+数为0.1NA
D.14g氮气中含有7NA个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如图:
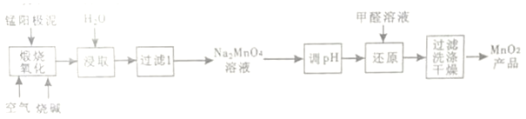
(1)“煅烧氧化”时,1molMnO煅烧完全转化为Na2MnO4失去电子___mol;
(2)为提高Na2MnO4的浸取速率,可采取的措施有___(列举2点)
(3)“调pH”是将溶液pH调至约为10,写出用pH试纸测定溶液pH的操作_____。
(4)MnO2煅烧反应的化学方程式为_____。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1.准确称取mg产品,加入c1mol·L-1Na2C2O4溶液V1mL (过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2.然后用c2mol·L-1KMnO4标准溶液滴定剩余的Na2C2O4滴定至终点时消耗KMnO4标准溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步骤2达滴定终点时判断依据是___;产品中MnO2的质量分数为ω(MnO2)=___(列出计算的表达式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表中实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 以酚酞为指示剂,用盐酸标准液滴定氢氧化钠溶液 | 溶液由红色变为浅红色便立刻读数 | 测得氢氧化钠溶液的浓度偏大 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO32-水解引起的 |
C | 室温下分别测定NaClO溶液、CH3COONa溶液的pH | 前者大 | 酸性:HClO>CH3COOH |
D | NaHCO3溶液中滴入酚酞 | 溶液变红 | 弱酸的酸式盐溶液均呈碱性 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】向某恒温恒容密闭容器中充入0.2 mol X,发生如下反应:2X(g)![]() Y(g)+3Z(g) ΔH=a kJ·mol-1(a>0)。下列说法正确的是
Y(g)+3Z(g) ΔH=a kJ·mol-1(a>0)。下列说法正确的是
A. 增大X的浓度,正反应速率增大,逆反应速率减小
B. 当混合气体的密度不再变化时,该反应达到化学平衡状态
C. 达到化学平衡状态时,共吸收 0.1a kJ的热量
D. 若平衡后再向反应器中充入 0.2 mol X,达平衡后,X的转化率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com