
科目: 来源: 题型:
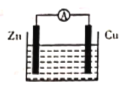
【题目】(1)向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。请回答下列问题:
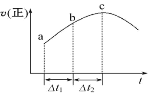
①a~c段反应速率增大的原因是____________。
②有关该反应的说法正确的是________(填字母)。
a.若容器内温度保持不变,可以说明反应达到了平衡状态
b.反应物浓度:a点小于b点
c.反应在c点达到平衡状态
d.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
e.若容器内气体的平均摩尔质量保持不变,可以说明反应达到了平衡状态
(2)利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示。此装置既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。请回答下列问题:
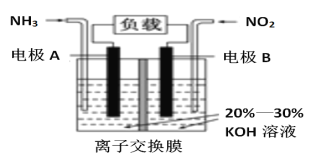
①B电极为______(填“正”或“负”)。
②当有4.48 L NH3(标准状况)参加反应时,转移电子数为________。
③电极A极反应式为______。
④为使电池持续放电,离子交换膜最好选用__________(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知元素X、Y均为短周期元素,X元素的一种核素常用于测文物的年代,Y元素原子半径是所有原子中最小的,元素X、Y可形成两种常见化合物M和N,已知M可以使高锰酸钾酸性溶液褪色,M分子中所含X元素的质量是Y元素质量的6倍,且M的相对分子质量为56。N是一种常用溶剂,它的实验式XY。回答下列问题:
(1)符合条件的M的有 ______种。
(2)任意写一种不带支链的M的结构简式__________。
(3)若在N与液溴的混合液中加入铁粉可以发生反应(在如图装置a容器中反应),则:
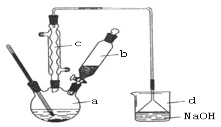
①写出a容器中发生的所有反应的化学方程式:_____________。
②d容器中NaOH溶液的作用是_____________。
(4)在碘水中加入N振荡静置后的现象是__________。
(5)等质量M、N完全燃烧时消耗O2的物质的量较多的是________(填“M”或“N”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】分别按如图甲、乙所示装置进行实验,图中两个烧杯里的溶液均为2L同浓度的稀硫酸,乙中A为电流表。请回答下列问题:
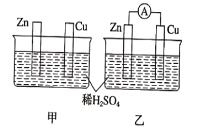
(1)以下叙述中,正确的是_______(填字母)
A.甲溶液中H+会向锌片移动
B.两烧杯中锌片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.甲中锌片是负极,乙中铜片是正极
E.乙的内电路中电流方向Zn→溶液→Cu
(2)实验时,甲、乙同时开始反应,0~15分钟内,测得甲中锌片质量减少了19.5克,乙中收集到氢气13.44升(已转化为标准状况),则用硫酸浓度的变化表示甲乙两装置的反应速率分别为:v(甲)=_________ mol·L-1·min-1,v(乙)=_________ mol·L-1·min-1,v(甲)___v(乙)(填>,<或 =),主要原因是__________。
(3)变化过程中能量转化的主要形式:甲为 _________;乙为____________。
(4)在乙实验中,如果把硫酸换成硝酸银溶液,请写出铜电极的电极反应方程式:_______,此时乙装置中正极的现象是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是
A. 锌做负极发生氧化反应
B. 供电时的总反应为Zn+2H+=Zn2++H2↑
C. 该装置可实现化学能转化为电能
D. 正极产生1 mol H2,消耗锌的质量为32.5 g
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温恒容条件下,反应2AB(g)![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成n mol A2,同时消耗2n mol AB
B. 容器内,3种气体AB、A2、B2共存
C. 容器中各组分的体积分数不随时间变化
D. AB的消耗速率等于A2的消耗速率
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
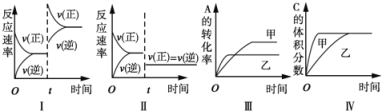
A. 图I表示增加反应物浓度对该平衡的影响
B. 图II表示减小压强对该平衡的影响
C. 图Ⅲ表示温度对该平衡的影响,温度:乙>甲
D. 图IV表示催化剂对该平衡的影响,催化效率:甲>乙
查看答案和解析>>
科目: 来源: 题型:
【题目】煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(1)煤的气化和液化可能提高煤的利用率。煤的气化技术的主要产物是___________。煤的液化技术又分为直接液化和间接氧化.将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为___________。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放.
①在燃烧前,可以采用微生物脱硫技术.原理如下:
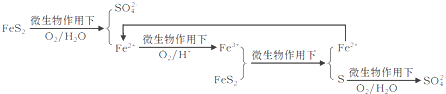
上述过程中Fe2+的作用为________________。写出Fe2+![]() Fe3+的离子方程式________________。
Fe3+的离子方程式________________。
②煤在燃烧时,进行脱硫处理,常采用________燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用.常用脱硫剂的主要化学成分为_______(填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术.湿法脱硫、脱硝技术中将烟气通入_________设备,用石灰水淋洗。
查看答案和解析>>
科目: 来源: 题型:
【题目】请按要求回答下列问题:
(1)某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,溶液pH值随溶液体积变化的曲线如右图所示。
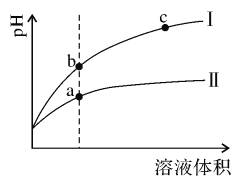
①稀释醋酸时pH值变化曲线是:___________(填:“I”或“Ⅱ”),
②b点溶液的导电性比c点溶液的导电性:___________(填:“强”、“弱”或“无法比较”),
③a、c两点Kw的数值相比,a___________c(填:“大于”、“小于”或“等于”),
(2)NH4Al(SO4)2在食品、医药、电子工业中用途广泛。
①NH4Al(SO4)2可做净水剂,其理由是:___________(用离子方程式表示)。
②相同条件下,0.1mol/L NH4Al(SO4)2溶液中,c(NH4+)___________0.1mol/L NH4HSO4溶液中c(NH4+)(填“大于”、等于”或“小于”)。
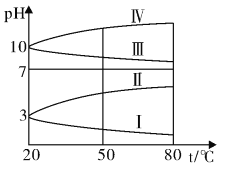
③下图是0.1mo/LNH4Al(SO)2溶液的pH随温度变化的图像,其中符合0.1mo/LNH4Al(SO4)2溶液的曲线是____ (填字母)。导致溶液pH随温度变化的原因是:_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为___。
(2)丙酮(CH3CCH3O)分子中碳原子轨道的杂化类型是__,1mol丙酮分子中含有σ键的数目为___。
(3)C、H、O三种元素的电负性由小到大的顺序为____。
(4)乙醇的沸点高于丙酮,这是因为______。
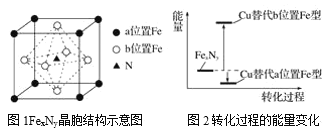
(5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为____。
1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g·cm-3。实验室制备少量1溴丙烷的主要步骤如下:步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20 mL水,冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24gNaBr。
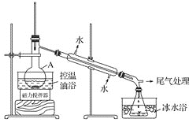
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12mLH2O、12mL 5% Na2CO3溶液和12 mL H2O洗涤,分液,得粗产品,进一步提纯得1溴丙烷。
(1)仪器A的名称是___;加入搅拌磁子的目的是搅拌和___。
(2)反应时生成的主要有机副产物有2溴丙烷和____。
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是_____。
(4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是___。
(5)步骤4中用5%Na2CO3溶液洗涤有机相的操作:向分液漏斗中小心加入12 mL5%Na2CO3溶液,振荡,___,静置,分液。
查看答案和解析>>
科目: 来源: 题型:
【题目】月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为_____________。
(2)Na的原子结构示意图为______,Na在氧气中完全燃烧所得产物的电子式为_______。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点________(填“高”或“低”)
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为______;SiO2的晶体类型为________。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为______(写化学式)。
(4)月壤中含有丰富的3He,从月壤中提炼1 kg3He同时可得6000kgH2和700kgN2,若以所得H2和N2为原料经一系列反应最多可制得碳酸氢铵___kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com