
科目: 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示。
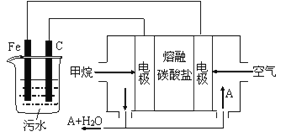
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的__________。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH
(2)电解池阳极发生了两个电极反应,电极反应式分别是
Ⅰ.___________________; Ⅱ._________________;
(3)电极反应Ⅰ和Ⅱ的生成物反应得到Fe(OH)3沉淀的离子方程式是__________________;
(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。
①负极的电极反应是____________________;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是_________________;
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)____L。
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]22H2O部分信息如下:
物理性质 | 化学性质 |
红棕色晶体,微溶于乙醇,难溶于冷水和乙醚(易挥发的有机溶剂) | 具有强还原性,易被氧化 |
制备原理:2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)=[Cr(CH3COO)2]22H2O(s)。
某兴趣小组设计实验制备[Cr(CH3COO)2]22H2O(s)。

回答下列问题:
(1)仪器A的名称是_____。
(2)检查装置B气密性的操作方法是_____。
(3)加入盐酸后,关闭K1,打开K2,将装置B中的导管抽出液面以上一段时间,目的是____。反应开始后,从装置B中看到的现象是溶液由深绿色(Cr3+)变为亮蓝色(Cr2+),且有气泡产生。写出装置B中发生的非置换反应的离子方程式:_____。
(4)当氢气的放出速率较快时,为了使装置B中溶液进入装置C中,宜采取的操作是_____;装置D中导管口水封的目的是_____。
(5)将装置C中所得产品提纯,其操作依次为过滤、去氧水洗涤、乙醚洗涤。相对乙醇或水,用乙醚洗涤的优点有______。
(6)测定产品纯度:取ag产品溶于蒸馏水,通入足量空气,充分反应后,加入过量氢氧化钠溶液,过滤、洗涤、灼烧、称重。得Cr2O3质量为mg(假设杂质不参与反应),[Cr(CH3COO)2]22H2O(s)的摩尔质量为Mg·mol-1。测得产品纯度为____ %。(用含a、m、M的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】298K时,向20mLcmol·L-1KOH溶液中滴加0.1mol·L-1HCOOH溶液,混合溶液中水电离的氢氧根离子浓度与滴加甲酸(弱酸)溶液体积(V)的关系如图所示。下列说法正确的是
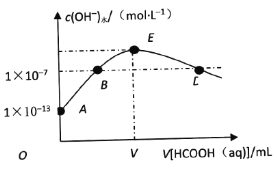
A. 上述KOH溶液的浓度c=0.01mol·L-1
B. B点对应的溶液中:c(K+)=c(HCOO-)
C. E点对应的溶液中:c(OH-)>c(H+)=c(HCOOH)
D. 若D点对应的甲酸溶液体积为V1mL,则HCOOH电离平衡常数![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物含量显得尤为重要。
Ⅰ.氮氧化物研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g),下列各项能说明反应达到平衡状态的是____________。
2NO2(g),下列各项能说明反应达到平衡状态的是____________。
a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2molNO同时生成2 molNO2
(2)汽车内燃机工作时会引起N2和O2的反应:N2+ O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g)
2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g)![]() 2NO(g)的△H____0(填“>”或“<”)。
2NO(g)的△H____0(填“>”或“<”)。

(3)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引发N2和O2反应,
其能量变化如图所示:
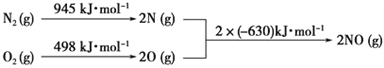
写出该反应的热化学方程式:________________________________。
Ⅱ.二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是坏境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(s)+O2(g)![]() 2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
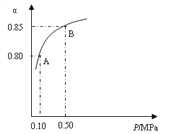
①将2.0 molSO2和1.0molO2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于__________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是中国在南极建设的第四个科学考察站——泰山站。为了延长科学考察站基础设施使用寿命,钢铁设备表面镶嵌一些金属块(M)。下列说法正确的是

A. 金属块M可能是铜,发生氧化反应
B. 这种保护方法叫牺牲阳极的阴极保护法
C. 科考考察站里的设备在潮湿空气中主要发生化学腐蚀
D. 若采用外加电流的阴极保护法,设备与电源正极相连
查看答案和解析>>
科目: 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。表列出了有关物质的部分物理性质,请回答:
)等产品。表列出了有关物质的部分物理性质,请回答:
名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 (ρ水=1g/cm3) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
 (1)装置a的名称是______________。
(1)装置a的名称是______________。
(2)三颈瓶中发生反应的化学方程式为_______________________________________。
(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是_____________________________________________。
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过_____、_____(填操作名称)等操作,才能得到苯甲醛粗产品。
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是_______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为_____。(苯甲酸相对分子质量:122.0)
查看答案和解析>>
科目: 来源: 题型:
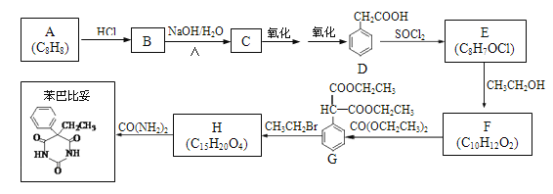
【题目】以A为原料合成安眠药——苯巴比妥的路线如下:
已知:ⅰ.CH3COOH+SOCl2![]()
![]() +SO2+HCl
+SO2+HCl
ⅱ. 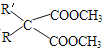 +CO(NH2)2
+CO(NH2)2![]()
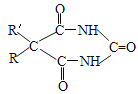 +2CH3OH(R、R为H原子或羟基)
+2CH3OH(R、R为H原子或羟基)
(1)A中官能团的名称是_____。
(2)B→C的化学方程式是_______________________________________。
(3)F为酯,其结构简式是______________________________________。
(4)F→G的反应类型是_________________________________________。
(5)H的结构简式是____________________________________________。
(6)G与CO(NH2)2在一定条件下合成的高分子结构简式是________________。
(7)D的同分异构体有多种,苯环上只有两个取代基且能发生银镜反应的有_____种,写出核磁共振氢谱中氢原子种类数最少的任一种同分异构体的结构简式_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1)H2 和CO合成甲醇反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为_______;10min内用H2表示的化学反应速率为_______;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有_______(填一种合理的措施)。
CH3OH(g) ΔH<0。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为_______;10min内用H2表示的化学反应速率为_______;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有_______(填一种合理的措施)。
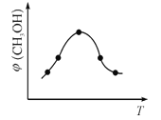
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g) +3H2(g) ![]() CH3OH(g) +H2O(g) ΔH
CH3OH(g) +H2O(g) ΔH
①该反应的平衡常数表达式为K=________。
②在恒容密闭容器中使CO2和H2(物质的量之比为1∶3),发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如下图所示,则 ΔH _________0(填“大于”或“小于”)
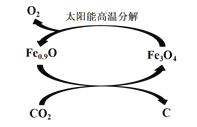
(3) 如下图所示,利用缺铁氧化物[如Fe0.9O]可实现CO2的综合利用。请说明该转化的2个优点_____________。若用1 mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成________mol C(碳)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼氢化钠(NaBH4,硼为+3价)为白色粉末,在干燥空气中稳定,在潮湿空气中分解,是常用的还原剂。偏硼酸钠(NaBO2)易溶于水,不溶于乙醇,易水解。目前有多种工艺可制备NaBH4。
(1)用硼精矿(含有一定量B2O3,及Al2O3、SiO2、Fe2O3等杂质)制取NaBH4的流程如下:

①“溶解”时,B2O3与NaOH反应生成了NaBO2,反应离子方程式为____。
②“除硅铝”步骤加入CaO,而不加入CaCl2的原因有:能将硅、铝以沉淀除去;尽量不带入杂质离子;___。
③“操作2”是将滤液蒸发、结晶、洗涤,其中洗涤选用的试剂最好是_____(填字母)。
a. 冷水 b. 乙醇 c. 氨水 d. NaOH溶液
④“反应1”是MgH2与NaBO2混合得到NaBH4和MgO,其化学方程式为________。
(2)我国孙彦平采用耐腐蚀电极材料,以阳离子交换膜为隔离膜,电解偏硼酸钠的碱溶液,也可以高效制备NaBH4。该工艺阳极产物为________,阴极电极方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】雄黄 (As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为______。
(2)上述反应中的氧化剂是_____,反应产生的气体可用____吸收。
(3)As2S3和HNO3有如下反应:As2S3 + 10H+ + 10NO3- = 2H3AsO4+ 3S+10NO2↑+ 2H2O,若生成2mol H3AsO4,则反应中转移电子的物质的量为____。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量_____(填字母)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com