
科目: 来源: 题型:
【题目】铝是地売中含量最多的金属元素,自然界中主要以Al2O3的形式存在于铝土矿中。工业上以铝土矿(主要成分是A12O3,杂质有SiO2、Fe2O3等)为原料制备金属铝,其工艺流程如图所示:
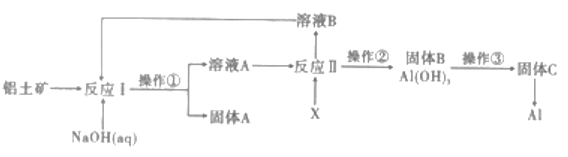
(1)操作①的名称是_________,实验室完成该操作所需的玻璃仪器主要有_________。
(2)为了提高反应的反应速率,可采取的措施有___________(答两条)
(3)调控反应I中钠铝元素之比一定时,Al2O3溶于NaOH,SiO2转化为铝硅酸钠沉淀。Al2O3与NaOH溶液反应的离子方程式为____________________。
(4)固体C→Al的化学反应方程式为__________________________。
(5)该生产过程中,需向反应Ⅱ中加入X
①X可为过量的CO2,则溶液B中主要的溶质是__________,为了使溶液B循环利用,应补充的物质是____________(填序号)
a. CaO b. HCl c. Na2 CO3
②X也可为少量Al(OH)3晶种(晶种可加速沉淀的生成),其优点是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,下列说法正确的是
A. CuI既是氧化产物又是还原产物
B. Cu(IO3)2作氧化剂,Cu(IO3)2中的铜和碘元素被还原
C. 每生成1 mol CuI,有12 mol KI发生氧化反应
D. 每转移1.1 mol电子,有0.2 mol![]() 被氧化
被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4 L CO和CO2的混合气体中所含的碳原子数一定是NA
B.标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1 NA
C.物质的量浓度为2mol/L的BaCl2溶液中,含有Cl-个数为4NA
D.标准状况下,11.2L H2O含有0.5NA分子
查看答案和解析>>
科目: 来源: 题型:
【题目】硫元素在自然界中通常以硫化物、硫酸盐或单质的形式存在,其单质和化合物在工农业生产中有着重要的作用。
(1)硫元素在周期表中的位置为___________,其最简单气态氢化物的电子式为_________。
(2)在工业上SO2可以用于制备H2SO4。
已知SO2(g)+![]() O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1
O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1
H2O(g)=H2O(l) △H2=-44kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H3=-130kJ·mol-1
则2SO2(g)+O2(g)=2SO3(g) △H=_____________kJ·mol-1
(3)某兴趣小组同学探究SO2的还原性,使用的药品和装置如图所示:

A瓶中发生反应的离子方程式为_______________________。B瓶中出现的现象为________。若要证明A、B的反应中SO2均显现还原性被氧化为SO42—,可以采取的操作和现象是_______________________________________。
(4)硫的氧化物排放到大气中会造成空气污染,常温常压下用如图所示传感器可以检测空气中SO2的含量。下列关于该传感器的叙述正确的是__________(填序号)。

A. a为电源的正极
B. Pt电极网上发生氧化反应
C.当电路中电子转移0.5mol时,进入传感器的SO2为11.2L
D.阴极的电极反应是2HSO3—+2H+-2e—=S2O42—+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.C燃烧的热化学方程式为:C(s)+1/2O2(g)=CO(g) △H = 110.5kJ·mol-1
B.由H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1可知,若将含1molCH3COOH的稀溶液与含1molNaOH的稀溶液混合,放出的热量小于57.3kJ
C.碳酸氢钠水解的离子方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D.500℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放出热量19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、Cu2+、CO32—、SO42—、NO3—中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法错误的是
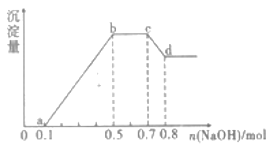
A. 溶液中的阳离子有H+、Mg2+、Al3+、NH4+
B. cd段的离子方程式为Al(OH)3+OH—=AlO2—+2H2O
C. 溶液中n(NH4+)=0.2mol
D. n(H+):n(Mg2+):n(Al3+)=1:1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 1.0 mol NaCl固体中含有NA个NaCl分子
B. 1 mol OH—和1mol—OH(羟基)中含有的质子数均为9NA
C. 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
D. 1L0.2molL—1的NaHCO3溶液中HCO3—和CO32—离子数之和为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】氧氮杂是新药研制过程中发现的一类重要活性物质,能用于改善大脑缺血。下面是某研究小组提出的一种氧氮杂类化合物E的合成路线:
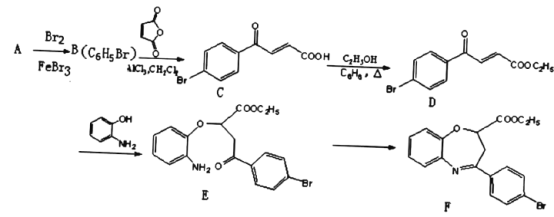
(1)A的结构简式为_____。C中官能团的名称为____。
(2)E→F经历两步反应,其反应类型依次为______、______。
(3)同时满足下列条件的D的一种同分异构体的结构简式为______。
I.分子中含有1个苯环;
II.能发生银镜反应;
III.分子中有5种不同化学环境的氢。
(4)1mol D与足量NaOH溶液反应时最多消耗_____molNaOH。
(5)由E合成F时还可能生成副产物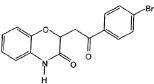 和一种常见的有机物G,G的结构简式为_______。
和一种常见的有机物G,G的结构简式为_______。
(6)已知: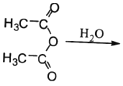 CH3COOH。原料
CH3COOH。原料![]() 俗名“马莱酐”,它是马莱酸
俗名“马莱酐”,它是马莱酸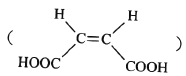 的酸酐。请写出以
的酸酐。请写出以![]() 为原料制备化合物
为原料制备化合物 的合成路线流程图(无机试剂任用)。______
的合成路线流程图(无机试剂任用)。______
合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() Br-CH2CH2-Br
Br-CH2CH2-Br
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钠具有强氧化性,下列说法不正确的是( )
A.过氧化钠与二氧化硫反应时可生成硫酸钠
B.1mol过氧化钠中阴离子数目约为6.02×1023
C.Na2O2与CO2反应时,Na2O2是氧化剂,CO2是还原剂
D.将等物质的量的Na2O和Na2O2分别溶于等质量的足量水中所得溶液的质量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法不正确的是
A.根据化合物在水溶液或熔融状态下是否导电,将化合物分为电解质和非电解质
B.氨气的水溶液能够导电,因此NH3是电解质
C.电解质溶液的导电能力与溶液中离子浓度及离子所带电荷多少有关
D.溶液与胶体的本质区别是分散质颗粒直径大小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com