
科目: 来源: 题型:
【题目】食盐不仅是日常生活的必需品,也是重要的化工原料。工业上通过海水硒盐得到粗产品再进行精制以获得纯NaCl,精制过程如图所示:

提供的试剂:Na2CO3溶液,NaOH溶液,BaCl2溶液。
粗盐产品中含有的杂质主要有硫酸盐和MgCl2、CaCl2。
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,“一系列操作”中滴加试剂的先后顺序为___、NaOH、____。(填化学式)
(2)加入碳酸钠可以除去溶液中的___(填化学式,下同)和过量的___。写出Na2CO3发生反应的两个化学方程式:___,___。
(3)加入过量盐酸的作用是___。
(4)写出盐酸参与反应的化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化工厂排放的污水中含有FeSO4、CuSO4两种物质。甲、乙、丙三位学生分别设计了从该污水中回收纯净金属铜的方案(如图所示)。
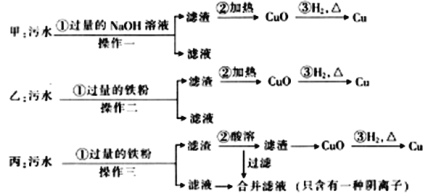
(1)甲、乙、丙提出的实验方案能否得到纯净的金属铜?
甲___,乙___,丙___。(填“能”或“不能”)
(2)在丙同学进行的“酸溶”操作中,加入的酸是___(填“稀盐酸”或“稀硫酸“)。合并的滤液中的主要溶质是___。
(3)丙同学的方案中,过程①加入过量的铁粉时发生反应的化学方程式为___。
(4)操作一、二、三的名称是___,该操作中需使用的玻璃仪器有___。
查看答案和解析>>
科目: 来源: 题型:
【题目】双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如下图所示,M、N为离子交换膜。
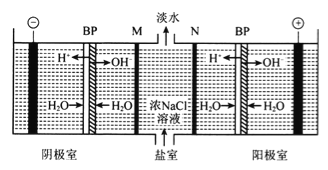
下列说法错误的是
A. 阴极室发生的反应为2H++2e-=H2↑
B. M为阳离子交换膜,N为阴离子交换膜
C. 若去掉双极膜(BP),阳极室会有C12生成
D. 电路中每转移1mol电子,两极共得到0.5 mol气体
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在标准状况下,1.7g氨气所占的体积为__L,它与标准状况下__L硫化氢含有相同数目的氢原子。
(2)同温同压下,SO2与氦气的密度之比为___;若质量相同,则两种气体的体积之比为___;若体积相同,两种气体的质量之比为___。
(3)在标准状况下,①4gH2;②11.2LO2;③1molH2O中,所含分子数最多的是(填序号,下同)___,含原子数最多的是___,质量最大的是___,体积最小的是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。高铁酸钾为暗红色粉末状晶体,干燥的晶体80℃以下十分稳定,它极易溶于水,难溶于异丙醇。实验室模拟生产工艺流程如图:
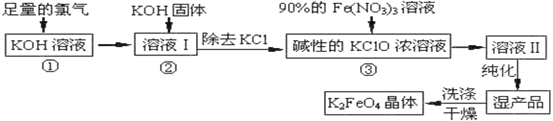
已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
③K2FeO4在水溶液中易水解:4FeO42-+10H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2↑
4Fe(OH)3(胶体)+8OH-+3O2↑
回答的下列问题:
实验室可以利用如图装置完成流程①和②
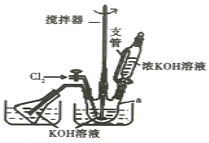
(1)恒压滴液漏斗支管的作用是_____,两水槽中的水为____(填“热水”或“冷水”)。
(2)反应一段时间后,停止通氯气,再往仪器a中加入浓KOH溶液的目的是______;判断浓KOH溶液已过量的实验依据是___。
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为____。
(4)用重结晶法提纯粗产品:将粗产品先用KOH稀溶液溶解,再加入饱和KOH溶液,冷却结晶,过滤,用少量异丙醇洗涤,最后低温真空干燥。
①粗产品用KOH溶解的目的是_____。
②如何判断K2FeO4晶体已经洗涤干净____。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氯化二硫(S2C12)用作有机化工产品、杀虫剂、硫化染料、合成橡胶等生产中的氯化剂和中间体。S2Cl2是一种有毒并有恶臭气味的浅黄色液体,在300℃以上完全分解,其蒸汽遇水分解,易溶解硫磺;将适量氯气通入熔融的硫磺而得,过量的Cl2会将S2Cl2进一步氧化得到SCl2。以下是对S2Cl2的制备及研究,请回答下列问题:
Ⅰ.S2Cl2的制备
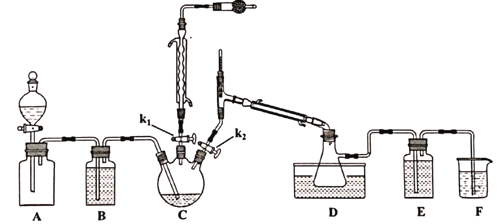
已知,各物质的熔沸点如下:
物质 | S | S2Cl2 | SCl2 |
沸点/℃ | 445 | 138 | 59 |
熔点/℃ | 113 | -76 | -122 |
制备的流程为:
①A装置集气瓶中充满Cl2,打开A装置中的分液漏斗,打开k1、k2,一段时间后关闭k2。
②接通冷凝水,将C加热至135~140℃。
③一段时间后关闭k1,同时打开k2,最后在D中收集到浅黄色液体。
(1)实验室制取氯气的反应方程式_________________________________。
(2)A装置分液漏斗中盛装的液体是___________。
A.CCl4 B.饱和NaHCO3溶液 C饱和NaCl溶液
(3)滴加过程要缓慢,原因是____________________________________________。
(4)D装置中水浴温度应控制为___________,原因是_______________________________。
Ⅱ.S2Cl2纯度的测定
已知:S2Cl2遇水分解的化学方程式:2S2Cl2+2H2O=3S↓+SO2↑+4HCl,取agⅡ中黄色液体于锥形瓶,加水至反应完全(假设杂质均不与水反应),向所得液中加入过量的C0 mol/L的AgNO3溶液V0mL。再向锥形瓶中加入硝基苯,将生成的沉淀覆盖。加入适量Fe(NO3)3作指示剂,用C1 mol/L NaSCN溶液滴定至终点,消耗 NaSCN溶液V1mL(滴定过程发生反应:Ag++SCN-= AgSCN↓)
(5)滴定终点的现象为_________________________________。
(6)S2Cl2的纯度为___________(写出表达式);若滴定过程中未加硝基苯,则所得纯度___________。(填“偏大”、“偏小”、“无影响”)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
C. 某溶液![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生欲用下列装置制取纯净FeCl3固体。其中A是Cl2的发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网,F为干燥的空广口瓶,烧杯G为尾气吸收装置。
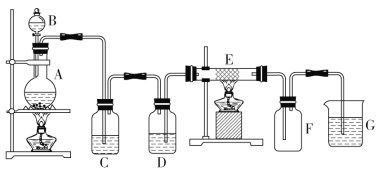
试回答:
(1)该装置中有一明显错误是____________(填字母)。
(2)D中所装试剂为_____________,C装置的作用是___________________。
(3)A中发生反应的化学方程式是__________________,G中发生反应的离子方程式是________________。
(4)若用100mL 12mol/L盐酸与足量MnO2充分反应,生成的Cl2体积(标准状况)________(填“大于”“小于”或“等于”)6.72 L。
(5)用所制取的FeCl3固体制成Fe(OH)3胶体,区分胶体和溶液常用________,分离胶体和溶液常用的方法叫_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)根据有机化合物分子中所含官能团,可对其进行分类和性质预测。
①下列有机化合物属于醇类物质的是____(填字母)。
a.CH3CH2OH b.CH3CHO c.![]()
②下列有机化合物中加入浓溴水能生成白色沉淀的是____(填字母)。
a.CH2=CH2 b.苯 c.![]()
③下列有机化合物能发生水解反应的是____(填字母)。
a.乙酸 b.油脂 c.葡萄糖
(2)有机物W(![]() )广泛存在于肉桂类植物的果肉中。
)广泛存在于肉桂类植物的果肉中。
①W分子中所含官能团的名称为____和____。
②W分子中处于同一平面的碳原子最多有____个。
③1mol W分子最多能与____mol H2发生加成反应。
(3)对羟基苯甲酸乙酯( )是常用的食品防腐剂,可通过以下方法合成:
)是常用的食品防腐剂,可通过以下方法合成:
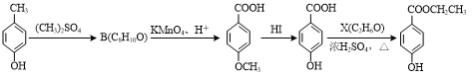
A C D E
①C→D的反应类型为____。
②B的结构简式为____。
③D与碳酸氢钠反应后所得有机物的结构简式为____。
④D→E反应的化学方程式为____。
⑤写出同时满足下列条件的C的一种同分异构体的结构简式:____。
Ⅰ.能和FeCl3溶液发生显色反应;
Ⅱ.能发生银镜反应,不能发生水解反应;
Ⅲ.分子中含有4种不同化学环境的氢原子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com