
科目: 来源: 题型:
【题目】已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为2KMnO4+10FeSO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3
+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如下图所示。下列有关说法不正确的是( )
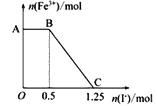
A. 图中AB段发生的是过量的酸性KMnO4溶液与KI的反应
B. 图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C. 根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D. 向C点以后的溶液中加入少量KSCN溶液,溶液变红色
查看答案和解析>>
科目: 来源: 题型:
【题目】钛工厂TiCl4烟尘中含有大量的ScCl3、MgCl2及SiO2小颗粒等物质,某研究所利用上述烟尘回收Sc2O3,并制备钛白粉(TiO2),其工艺流程如图所示:
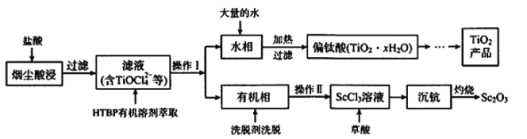
(1)在空气中灼烧草酸钪即可得到氧化钪(Sc2O3),其化学反应方程式为_____。
(2)“水相”的主要离子有TiOCl42-、H+、Cl-及Mg2+,写出加入大量的水并加热发生的相关离子反应方程式_____。
(3)酸浸过程中,稍过量的盐酸的作用除溶解吸收烟尘外,另外还有的作用是_______。
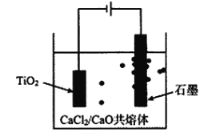
(4)钛的冶炼新法是剑桥电解法(如图)。以含少量CaCl2的CaO熔融物作为介质,电解时。在阴极生成的Ca进一步还原TiO2得钛。利用中学所学知识可以预测CaCl2的作用包含增强导电性及______。
查看答案和解析>>
科目: 来源: 题型:
【题目】用Na表示阿伏加德罗常数的值,下列叙述错误的是
A.含有NA个氢原子的氢气在标准状况下的体积约为11.2L
B.25℃,1.01×105Pa,64gSO2中含有的原子数为3Na
C.在常温常压下,35.5g Cl2含有的分子数为0.5Na
D.标准状况下,11.2LH2O含有的分子数为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】将1 mol CO和2 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生 反应:CO(g)+2H2(g)=CH3OH(g),ΔH=a kJ/mol,如图。下列分析中正确的是

A.250°C时,010minH2 反应速率为 0.015 mol,/(L.min)
B.平衡时CO的转化率:T℃时小于250℃时
C.其他条件不变,若减小容积体积,CO体积分数增大
D.a<0,平衡常数K:T0C时大于2500C
查看答案和解析>>
科目: 来源: 题型:
【题目】次氯酸溶液是常用的消毒剂、漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
(查阅资料)资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
(装置及实验)用以下装置制备次氯酸溶液

回答下列问题:
(1)各装置的连接顺序为____→_____→_____→____→E;
(2)装置 A 中反应的离子方程式是__________________;
(3)装置 E中反应的化学方程式是_____________________;
(4)装置 B 中多孔球泡和搅拌棒的作用是____,反应过程中,装置B需放在冷水中,其目的是____。
(5)装置C的主要作用是_____________________;
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)______________。
(7)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为___g。
(8)配平下列离子方程式:______Fe(OH)3+ ClO![]() + OH
+ OH![]() — FeO42-+ Cl-+ H2O。
— FeO42-+ Cl-+ H2O。
查看答案和解析>>
科目: 来源: 题型:
【题目】将11.2g铁投入200mL某浓度的盐酸中,铁和盐酸恰好完全反应。求:
(1)所用盐酸中HCl的物质的量浓度?___
(2)反应中生成的H2在标准状况下的体积为多少升?___
(3)取100mL该浓度的盐酸与100mL5mol/L盐酸混合均匀,再加水稀释至250mL,求此时盐酸的物质的量浓度?___
查看答案和解析>>
科目: 来源: 题型:
【题目】今有一澄清溶液,只可能含有下表中的若干种离子(存在的离子均大量):
阳离子 | K+、NH4+、H+、Ba2+ |
阴离子 | Cl-、CO32-、SO42-、OH- |
现取三份上述澄清溶液各100 mL,分别进行以下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加入足量NaOH溶液加热后,收集到气体0.04 mol。
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤,干燥后,沉淀质量为2.33 g。
请回答下列问题:
(1)根据第②个实验可以确定存在的离子是_______;
(2)除(1)中确定存在的离子以外,还一定存在的离子是__________,可能存在的离子是______;
(3)第③个实验中沉淀减少的原因是(用离子方程式表示)______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75%,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为常见的无色液体。反应生成的水均已略去。它们有如下图所示的关系。
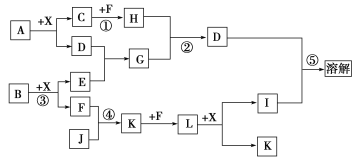
(1)写出化学式:A________,B________,J________;
(2)反应③中每生成1 mol F,转移电子的数目为______________;
(3)反应④的化学方程式为:______________________________;
(4)写出离子方程式:反应②________________________________,反应⑤________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电解质溶液中有关浓度关系不正确的是( )
A. 浓度均为0.1 mol/L的HF、KF混合溶液中:2c(H+)+c(HF)=2c(OH-)+c(F-)
B. 0.1 mol/L的Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C. 常温下,pH=5的NaHSO3溶液中,水电离出的c(H+)=1.0×10-9 mol/L
D. NH4+浓度均为0.1 mol/L的 ①NH4Cl、②NH4Al(SO4)2、③NH4HCO3三种溶液的浓度:③>①>②
查看答案和解析>>
科目: 来源: 题型:
【题目】雄黄 (As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为______。
(2)上述反应中的氧化剂是_____,反应产生的气体可用____吸收。
(3)As2S3和HNO3有如下反应:As2S3 + 10H+ + 10NO3- = 2H3AsO4+ 3S+10NO2↑+ 2H2O,若生成2mol H3AsO4,则反应中转移电子的物质的量为____。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量_____(填字母)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com